Médicaments inutiles, toxiques et hors de prix – Exemple 9 : Vectibix* et cancer du colon : autre espoir déçu
Exemple 9 : Vectibix* et cancer du colon : autre espoir déçu
Le panitumumab (Vectibix*) est un anticorps monoclonal IG2 dirigé contre le facteur de croissance tumoral EGFR et susceptible de ralentir la croissance des tumeurs et en particulier des cancers du côlon.
Une étude initiale dite PIVOT : gain de cinq jours de stabilisation contre rien !
Il a bénéficié d’un processus d’autorisation accélérée de mise sur le marché par la FDA en 2006[1] sur la foi d’une étude pivot affirmant (sur 463 malades suivis en moyenne 9 mois) qu’il augmentait la durée médiane de stabilisation tumorale de 5 jours (8 semaines avec Vectibix* versus 7.3 sans traitement) sans augmenter la durée de survie globale[2]. Mais même ce pauvre et maigre bénéfice n’a pas été confirmé par les études ultérieures.
Inutile, voire nocif dans la population tout venant atteinte de cancer colorectal métastatique. Perte de plusieurs mois de vie !
Dans la population sans sélection génétique, le vectibix* est inutile, et souvent même, délétère. Dans l’essai Pacce[3], l’addition du vectibix* à l’association bevacizumab-oxaliplatine diminue la survie sans progression médiane de 1,5 mois (8,5 mois avec Vectibix contre 10 mois sans la drogue) et la survie globale de 5 mois (19,4 vs 24.5 mois) tout en augmentant la toxicité. Ce sévère échec du vectibix* a motivé l’avis de juillet 2010 de la HAS : « Cette utilisation constitue une situation non acceptable ».
Nouvel espoir : un groupe de patients dont la tumeur est dite « sauvage » serait-il plus sensible à l’effet du Vectibis* ? Non , la tumeur serait moins méchante, mais indépendamment !
En 2014, il a bénéficié d’une nouvelle AMM comme traitement de seconde ligne après l’essai Prime III (sur 656 malades) proclamant que l’ajout de vectibix* à la chimiothérapie Folfox augmentait de 48 jours la stabilisation tumorale[4] et de 4 mois la durée médiane de survie globale des malades souffrant de tumeurs coliques Kras non mutées(Kras sauvage ou WT).
Mais la même année, l’essai 20050181[5] étudiait l’effet de l’ajout de vectibix* à la chimiothérapie Folfiri (sur 557 malades suivis en moyenne 59 semaines). Il proclamait que l’addition de vectibix* au folfiri augmentait de 84 jours la non progression tumorale des tumeurs Kras non muté , mais sans apporter aux malades d’amélioration significative de la survie globale[6].
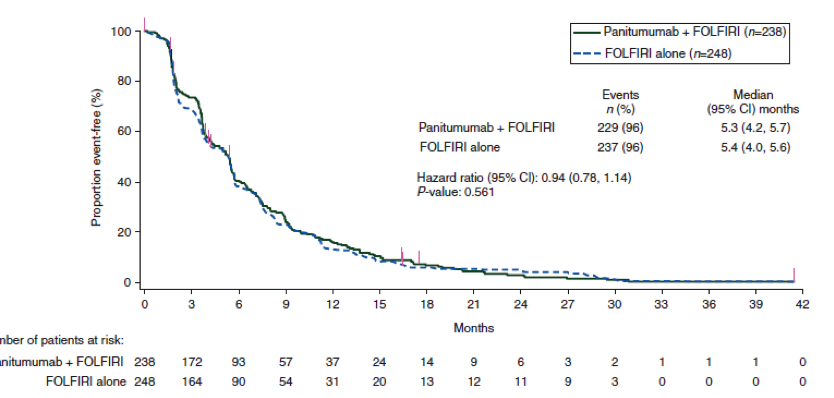
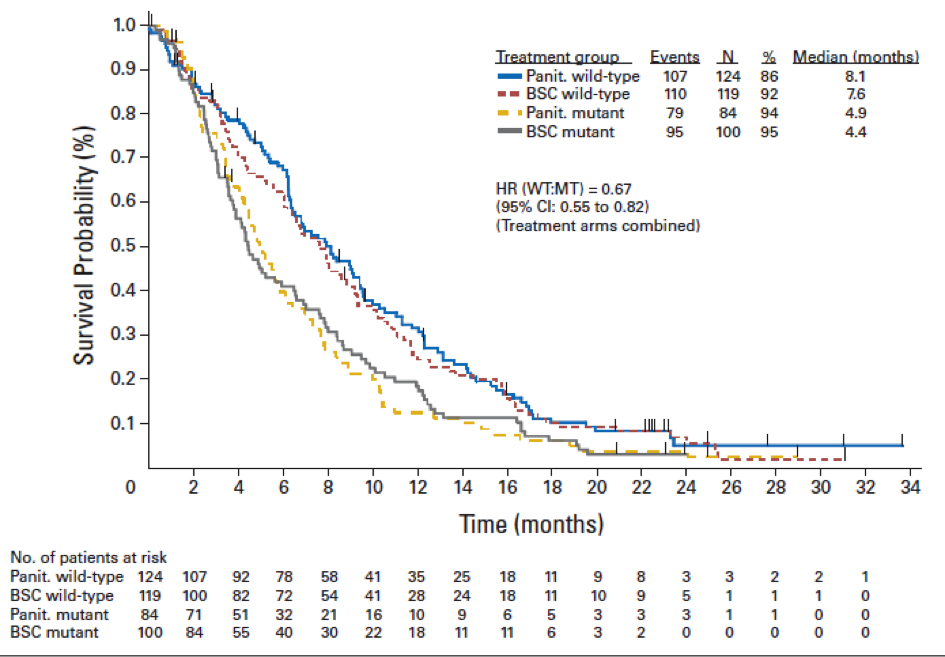
On peut alors se demander si le « Kras status WT » ne confère pas un avantage pronostique par lui-même, ainsi que le suggèrent les courbes suivantes tirées de l’analyse d’Amado[7] : elles ne mettent en évidence aucun gain significatif de survie globale, même pour les malades atteints de tumeurs « Kras sauvage ».
Pas d’effet non plus en deuxième ligne de traitement.
Dans l’étude Piccolo, l’ajout du vectibix* à la chimiothérapie de deuxième ligne des malades souffrant de tumeurs Kras sauvage n’augmente pas la survie globale et aggrave la toxicité[8].
Le vectibix* ne parait pas non plus utile après échec d’erbitux* (cetuximab)[9] [10].
La méta analyse de 2015 de Rosa[11] conclue « l’addition d’antigènes monoclonaux à la chimiothérapie des cancers coliques ne prolonge, ni la stabilisation tumorale, ni la survie globale ».
Le NICE [12] ne recommande pas sa prescription[13] ni la Haute Autorité de santé qui précise : « En l’état actuel des données, VECTIBIX* n’apporte pas d’amélioration du service médicale rendu (ASMR V, inexistante) dans la prise en charge du cancer colorectal métastatique avec un statut RAS non muté ».
Pas utile, mais dangereux.
Ce traitement expose en outre à de multiples complications : complications cutanées exacerbées par l’exposition au soleil, kératite pouvant devenir ulcérative, réaction allergique lors de la perfusion (sévère chez 1% des malades) fièvre , toux, dyspnée, bronchospasme, chute tensionnelle menaçant parfois la vie, douleurs abdominales, stomatite, diarrhées (23%), nausées (5%), vomissements(5% ), déshydratation (16%) pouvant entrainer une défaillance rénale, infection (3%), troubles métaboliques (hypo-magnésémie, hypocalcémie, hypokaliémie,), pneumopathie interstitielle pouvant entrainer la mort, fibrose pulmonaire .
Insuffisamment efficace sur la tumeur, incapable d’augmenter la survie des malades, quel que soit le statut Kras de la tumeur, et toxique le vectibrix* se révèle donc inutile.La revue Prescrire classe le vectibix* dans sa liste des médicaments dangereux[14].
Pourquoi est -il encore autorisé et remboursé à ce jour ?
Il faut une fois de plus souligner la responsabilité des agences de régulation des médicaments (FDA et EMA) qui ont accordé une autorisation de mise sur le marché à un médicament supposé ralentir de 5 jours (!!!) la progression tumorale sans prolonger la survie et transformé ainsi à leur insu de nombreux malades en cobayes. Cobayes dont un grand nombre (les 55% de malades Kras mutés), ont du fait de cette AMM, perdu 5 mois de survie, tout en souffrant de complications auxquelles ils n’auraient jamais dû être exposés.
On doit aussi rappeler la responsabilité du ministre de la santé qui a accepté de payer à un prix exorbitant ce médicament globalement inutile et dangereux et creusé un peu plus le déficit de la sécurité sociale, alors que d’autres pays voisins en ont refusé le remboursement.
LISTE I
| Médicament réservé à l’usage hospitalier. | ||
| Prescription réservée aux spécialistes en oncologie ou en hématologie, ou aux médecins compétents en cancérologie. | ||
| Médicament nécessitant une surveillance particulière pendant le traitement. | ||
| AMM | EU/1/07/423/001 ; CIP 3400957181857 (RCP rév 10.11.2016) 5 ml. | |
| EU/1/07/423/003 ; CIP 3400957182168 (RCP rév 10.11.2016) 20 ml. | ||
| Collect, excepté dans l’indication « en première ligne en association avec un protocole FOLFIRI », non agréée aux collectivités à la date du 16.03.2017 (demande d’admission à l’étude). | ||
| Prix ou tarif de responsabilité (HT) par UCD : | UCD 3400893071830 (flacon de 5 ml) : 365,500 euros. | |
| UCD 3400893071779 (flacon de 20 ml) : 1462,000 euros. | ||
| Inscrit sur la liste des spécialités prises en charge en sus des GHS. | ||
Titulaire de l’AMM : Amgen Europe BV, Minervum 7061, NL-4817 ZK Breda, Pays-Bas.
—
[1] Giusti RM et al (2008) US Food and Drug Administration approval: panitumumab for epidermal growth factor receptor expressing metastatic colorectal carcinoma with progression following fluoropyrimidine, oxaliplatin, and irinotecan-containing
chemotherapy regimens Clin Cancer Res 14(5) 1296–302
[2] Van Cutsem E, Peeters M, Siena S, et al. Open-label phase III trial of panitumumab plus best supportive care alone in patients with chemotherapyrefractory metastatic colorectal cancer. J Clin Oncol. 2007;25:1658–1664
[3] J. R Hecht A Randomized Phase IIIB Trial of Chemotherapy, Bevacizumab, and Panitumumab Compared With Chemotherapy and Bevacizumab Alone for Metastatic Colorectal Cancer J Clin Oncol 27:672-680. © 2008
[4] Douillard JY, Siena S, Cassidy J, Tabernero J, Burkes R, Barugel M, et al. Randomized, phase III trial of panitumumab with infusional fluorouracil, leucovorin, and oxaliplatin (FOLFOX4) versus FOLFOX4 alone as first line treatment in patients with previously untreated metastatic colorectal cancer: the PRIME study. J Clin Oncol 2010;28(31):4697-4705.
[5] M. Peeters et al Final results from a randomized phase 3 study of FOLFIRI ± panitumumab for second-line treatment of metastatic colorectal cancer Annals of Oncology 25: 107–116, 2014
[6]M. Peeters et al Final results from a randomized phase 3 study of FOLFIRI ± panitumumab for second-line treatment of metastatic colorectal cancer Annals of Oncology 25: 107–116, 2014
[7] Rafael G. Amado, Wild-Type KRAS Is Required for Panitumumab Efficacy in Patients With Metastatic Colorectal Cancer Clin Oncol 26:1626-1634. © 2008
[8] M T Seymour Panitumumab and irinotecan versus irinotecan alone for patients with KRAS wild-type, fl uorouracil-resistant advanced colorectal cancer (PICCOLO): a prospectively stratified randomised trial, Lancet Oncol 2013; 14: 749–59
[9] Wadlow RC, Panitumumab in patients with KRAS wild-type colorectal cancer after progression on cetuximab. Oncologist 2012; 17: 14
[10] Ohhara Y, Circulating Tumor Cells as Prognostic Marker in Japanese patients with Kras Wild-type Metastatic Colorectal Cancer Receiving Panitumumab after Progression on Cetuximab. J Cytol Histol 2014 5: 204
[11] Bruno Rosa, Effectiveness and safety of monoclonal antibodies for metastatic colorectal cancer treatment: systematic review and meta-analysis ecancer 2015, 9:582 DOI: 10.3332/ecancer.2015.582
[12] NICE agence du médicament anglaise.
[13] Hoyle, M, Crathorne, L, Peters, J, et al. The clinical effectiveness and cost-effectiveness of cetuximab (mono- or combination chemotherapy), bevacizumab (combination with non-oxaliplatin chemotherapy) and panitumumab (monotherapy) for the treatment of metastatic colorectal cancer after first-line chemotherapy (review of technology appraisal No.150 and part review of technology appraisal No. 118): a systematic review and economic model. Health Technol Assess. 2013 Apr;17(14):1-237
[14] « Pour mieux soigner, des médicaments à écarter : bilan 2017 » Rev Prescrire 2017 ; 37 (400) : 137-148.


