Kinder sind nicht durch covid-19 gefährdet; Ungetestete Impfstoffe injizieren zu wollen, ist kriminell und unnötig.
Seit mehr als einem Jahr träumen Lobbyisten von Pharmaunternehmen davon, der gesamten Weltbevölkerung eine Impfung gegen Covid-19 aufzuerlegen, indem sie Impfpflichten und „geimpfte oder sozial tote“ Erpressungen anwenden.
Und seit mehr als einem Monat greifen sie Kinder an [1], obwohl sie nicht dem Risiko von Covid-19 ausgesetzt sind, dass sie es nicht übertragen und dass es keine Beweise dafür gibt, dass Impfstoffe für sie wirksam und sicher sein können.
Kinder sind von Covid-19 nicht gefährdet und können daher keinen individuellen Nutzen aus der Anti-Covid-19-Impfung ziehen.
Alle berichteten Serien [2] [3] [4] [5] [6] [7] [8] und alle nationalen und internationalen Umfragen bestätigen, dass Covid-19 bei Kindern selten und fast immer gutartig ist und dass sie sind weniger von Covid-19 als von saisonaler Grippe bedroht.
In Frankreich verzeichnete Public Health France seit einem Jahr nur drei Todesfälle, die Covid zugeschrieben werden (alle leiden an chronischen Krankheiten, Krebs oder Immunschwäche), von fast 8 Millionen Kindern und Jugendlichen unter 15 Jahren, an denen die Grippe durchschnittlich abtötet 8 Personen pro Jahr in dieser Altersgruppe.
Die WHO [9] bestätigt, dass Kinder praktisch gefährdet sind:
Dieses winzige Risiko bedeutet, dass von der Impfung bei Kindern kein individueller Nutzen zu erwarten ist, während in den Medien überall über Komplikationen nach der Impfung berichtet wird, die manchmal schwerwiegend bis zum Tod sind.
Kinder sind keine Überträger für die Ausbreitung von Krankheiten; Eine Impfung würde den Verlauf der Epidemie nicht verändern.
Alle berichteten Serien und alle nationalen und internationalen Umfragen zeigen, dass Kinder und Jugendliche keine Übertragungsvektoren sind und nicht von Schulkameraden, sondern in der Regel von Eltern zu Hause infiziert werden.
Mehr als 20 epidemiologische Studien in einem Dutzend Ländern haben hartnäckig nach Kontamination von Kindern unter 15 Jahren gesucht: Keine konnte ein einziges wirklich überzeugendes Beispiel hervorheben.
Die Inserm-Studie [10] ist sehr demonstrativ. Das Kind von Contamines hatte während seiner Krankheit Kontakt zu 172 Personen, darunter 112 Schüler und Lehrer in drei Schulen und einem Skiclub. Er infizierte niemanden, nicht einmal die beiden anderen Kinder seiner Geschwister. Und die von einem Erwachsenen aus Singapur mitgebrachte Infektion blieb auf die Bewohner des Chalets beschränkt.
An der Studie des Instituts Pasteur über Grundschulen in Crépy-en-Valois [11] nahmen 1.340 Personen teil, darunter 139 Infizierte (81 Erwachsene und 58 Kinder). Unter 510 Schülern aus sechs Grundschulen identifizierten sie drei Kinder aus drei verschiedenen Schulen, die infiziert waren, als die Schulen noch geöffnet waren. Keines dieser drei Kinder infizierte jemanden, egal ob es sich um andere Studenten oder Erwachsene handelte.
Die Coville-Studie [12] der Activ-Gruppe (Klinische und therapeutische Kindervereinigung von Val-de-Marne) unter der Leitung von Professor Robert Cohen, Vizepräsident der Französischen Pädiatrischen Gesellschaft, umfasste 600 Kinder von Geburt an im Alter von 15 Jahren die Schlussfolgerung, dass: „ Ohne eine Geschichte der elterlichen Covid hat das Kind nichts . « »
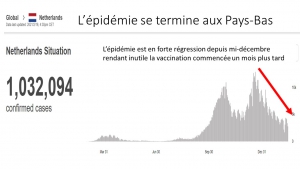
In den Niederlanden machen Kinder im Alter von 0 bis 17 Jahren nur 1,3% aller mit Covid-19 gemeldeten Patienten aus, obwohl sie 20,7% der Bevölkerung ausmachen. Nur 0,6% der gemeldeten Krankenhauseinweisungen erfolgten bei Kindern unter 18 Jahren, und es gibt keine Fälle, in denen Kinder an Covid-19 sterben. Eine Haushaltsstudie in den Niederlanden berichtete über Daten zu 116 Kindern im Alter von 1 bis 16 Jahren [13], und vorläufige Ergebnisse zeigten, dass es keine Hinweise darauf gibt, dass Kinder unter 12 Jahren die ersten waren, die in der Familie infiziert waren.
In Irland [14] wurde vor Schließung der Schulen bei 924 Kindern und 101 Erwachsenen, die mit sechs Infizierten in Kontakt standen (drei Kinder, drei Erwachsene), kein Fall von Schulkontamination festgestellt.
In Australien [15] [16] hatten 9 Schüler und 9 mit SARS-CoV-2 infizierte Mitarbeiter in 15 Schulen engen Kontakt zu insgesamt 735 Schülern und 128 Mitarbeitern. Es wurden nur 2 Sekundärinfektionen identifiziert, keine bei erwachsenen Mitarbeitern. 1 Grundschüler wurde möglicherweise von einem Mitarbeiter infiziert.
In der Schweiz [17] : Von insgesamt 4.310 Patienten mit SARS-CoV-2 waren 40 jünger als 16 Jahre (0,9%). Unter den 111 positiven Familienkontakten der untersuchten Kinder überwogen Mütter (n = 39), gefolgt von Vätern (n = 32), pädiatrischen Geschwistern (n = 23), erwachsenen Geschwistern (n = 8) und Großeltern (n = 7). .
In Finnland kam ein 12-jähriges Kind, das während seiner Krankheit zur Schule ging, mit 121 Menschen in Kontakt und infizierte keine von ihnen.
In Griechenland [18] ergab die epidemiologische Analyse von 23 Clustern, von denen 109 Personen betroffen waren (66 Erwachsene und 43 Kinder), keinen Fall einer Übertragung von einem Kind.
In Singapur [19] fanden zwei Grundschulen und eine weiterführende Schule Covid-19-Kinder. Keiner der 34 identifizierten Grundschulkontakte wurde positiv getestet. Von den 77 Highschool-Kontakten entwickelten 8 grippeähnliche Symptome, aber keiner von ihnen wurde positiv getestet.
Von den mehr als 11.180 Artikeln zum Thema Kinder und Covid-19, die PubMed am 09.04.2021 aufgelistet hat, und den 1.794 Artikeln, die speziell der möglichen Übertragung durch Kinder gewidmet sind, liefert keiner einen Nachweis über die Übertragung von einem Kind auf ein anderes Kind oder auf einen Erwachsenen in der realen Welt [20] [21] [22] [23] [24] .
Die einzigen Artikel, die diese Möglichkeit erwähnen, basieren auf der Viruslast oder auf Modellen mit falschen Annahmen.
Zugegeben, Kinder in der Schule können krank sein oder positiv getestet werden, aber unter asymptomatischen sind es meistens falsch positive (mehr als 90%) oder alte Infektionen, die sie zu Hause bekommen haben und von denen sie geheilt werden. Schulübertragungen sind möglich, aber alle, die Gegenstand einer ernsthaften epidemiologischen Untersuchung waren, zeigen, dass sie mit erwachsenem Personal verbunden sind.
Da Kinder an der Übertragung der Krankheit unschuldig sind, würde ihre Impfung, selbst wenn sie wirksam wäre, nichts zum Schutz anderer beitragen.
Aktuelle Impfstoffe verhindern nicht die Übertragung von Krankheiten!
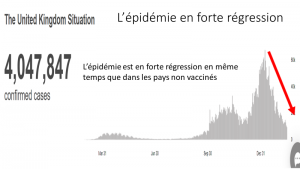
In Ländern, die sich für Impfkampagnen einsetzen, werden die Übertragungen fortgesetzt und manchmal sogar erhöht.
So war in den Vereinigten Arabischen Emiraten die Verbreitung des Virus seit der Impfung intensiver

Gleiches Phänomen in Bahrain:

Gleiche Entwicklung in Chile

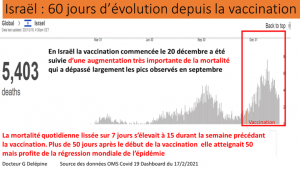
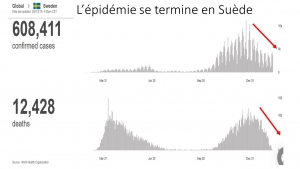
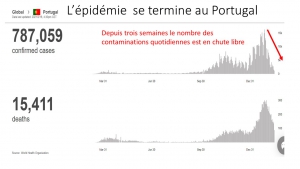
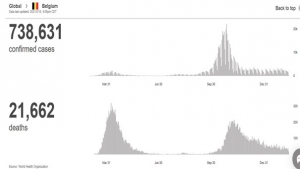
Der Vergleich der Entwicklung der Mortalität in Großbritannien mit und ohne Impfung sowie in unbeschränktem und schlecht geimpftem Schweden legt sogar nahe, dass die Impfung die Übertragung und Mortalität zumindest vorübergehend verschlechtert.

Diese sehr zweifelhafte Wirksamkeit der derzeitigen Impfstoffe zur Verhinderung der Übertragung des Virus wird von der Hohen Gesundheitsbehörde anerkannt und von O. Véran in seinem jüngsten Argument vor dem Staatsrat [25] formalisiert : » Der Impfstoff verhindert nicht die Übertragung den Virus an Dritte. « »
Selbst wenn die Kinder ansteckend wären, wäre ihre Impfung daher unwirksam, um andere zu schützen, da Impfstoffe die Übertragung nicht unterbrechen können!
Impfstoffe sind nicht einmal experimentell bei Kindern: Sie wurden noch nicht einmal getestet!
Bei Erwachsenen sind Impfstoffe experimentell, da die Studien nicht vor 2023 abgeschlossen sein werden. Bei Kindern sind sie nicht einmal experimentell, da die Studien bis vor kurzem diejenigen unter 16 Jahren ausschlossen und die erste Studie bei Kindern nach einem Unfall vor der signifikanten Einbeziehung von Meerschweinchen abgebrochen wurde .
Es handelt sich also um ein Medikament, das in ihnen überhaupt nicht getestet wurde und das keine MA erhalten hat, auch wenn es bedingt ist, dass die Impfstoffe Kindern injizieren möchten, die es nicht benötigen!
Um unsere Freiheiten wiederzugewinnen, müssen wir es nur wollen!
Das von Stéphane Dhersin angeregte Argument der Impfung von Kindern, « das notwendig ist, um unsere Freiheiten wiederzugewinnen « , greift die klassische Erpressung von Impfstoffanwälten auf. Dieses Argument basiert nicht auf wissenschaftlich fundierten Tatsachen, sondern auf gefälschten / falschen mathematischen Prophezeiungen.
Schweden, Weißrussen, Finnen und Niederländer, die noch nie eingesperrt waren, leiden unter einer geringeren Sterblichkeit als wir.
Der Gouverneur von Texas hat am 10. März alle angeblichen Gesundheitsbeschränkungen aufgehoben und seitdem ist die Sterblichkeit zurückgegangen, da sie in Staaten (Michigan, Minnesota) zunimmt, die immer noch sozialen Beschränkungen unterliegen.
In einem kurzen Artikel im Lancet erklären Delfraissy [26] und vier weitere Mitglieder des Wissenschaftlichen Rates, dass wir die Gesundheitspolitik ändern, keine episodischen Einschränkungen mehr anwenden und uns nicht mehr auf Impfungen verlassen müssen, um aus der Krise herauszukommen. Warum hören wir ihnen nicht zu?

Lasst uns keine unnötige Angst mehr haben. Hören wir auf, das psychische Gleichgewicht, die Gesundheit, die Bildung und die berufliche Zukunft unserer jungen Menschen zu zerstören. unsere Wirtschaft.
Und opfern Sie Kinder nicht mit falschen Überzeugungen und Modellen, die nur für Aktionäre von Impfstoffhändlern nützlich sein können.
Kinder haben kein Risiko für Covid-19 und sind keine Vektoren von Covid-19. Der Versuch, ihnen ungetestete Impfstoffe zu injizieren, ist kriminell.
Dr. Gérard Delépine
[1] Antoine Beau Covid: Sollten Kinder geimpft werden, um im September wieder zum normalen Leben zurückzukehren? WISSENSCHAFT
04/07/2021
„Die Impfung von Minderjährigen ist ein potenzieller Hebel für Maßnahmen im Kampf um eine normale Wiederbelebung“, erklärt Jean-Stéphane Dhersin, Modellbauer
[2] Peter Brodin Warum ist COVID-19 bei Kindern so mild? Editorial Acta Pediatrica 24. März 2020
[3] Ji Young Park Erster pädiatrischer Fall der Coronavirus-Krankheit 2019 in Korea J Korean Med Sci. 2020, 23. März; 35 (11)
[4] LiangSua die verschiedenen klinischen Merkmale von Fällen von Koronaviruserkrankungen zwischen Kindern und ihren Familien in China – der Charakter von Kindern mit COVID-19 Emerging Microbes & Infections 2020, VOL.
[5] Neuartige Coronavirus-Infektion mit Qinxue Shen bei Kindern außerhalb von Wuhan, China Pediatr Pulmonol. 2020 Apr 7. doi: 10.1002 / ppul.24762. Online vor dem Druck
[6] Ya-Nan Han et al. Eine vergleichend-deskriptive Analyse der klinischen Merkmale in der mit Coronavirus infizierten Kinder- und Erwachsenenpädiatrie 2019, April 2020
[7] Zhonghua Er Ke Za Zhi für die Pediatric Society und die Chinese Medical Association: Empfehlungen für die Diagnose, Prävention und Kontrolle der neuartigen Coronavirus-Infektion 2019 bei Kindern (erste Zwischenausgabe). 2020; 58: 169–74.]., Chinese Journal of Pediatrics
[8] Haiyan Qiu Klinische und epidemiologische Merkmale von 36 Kindern mit Coronavirus-Krankheit 2019 (COVID-19) in Zhejiang, China: eine Beobachtungskohortenstudie Lancet Infect Dis. 2020 25. März; S1473-3099 (20) 30198-5.
[9] Das WHO-Covid19-Dashboard wurde am 04.09.2021 konsultiert
[10] Kostas DANIS et al. Für Santé Publique France Cluster der Coronavirus-Krankheit 2019 (Covid-19) in den französischen Alpen, 2020 Klinische Infektionskrankheiten Oxford University Press für die Infectious Diseases Society of America.
[11] SARS-CoV-2-Infektion von Fontanet et al. In Grundschulen in Nordfrankreich: Eine retrospektive Kohortenstudie in einem Gebiet mit hoher Transmission medRxiv 2020
[12] Christèle Gras-Le Guen https://theconversation.com/rentree-scolaire-la-covid-19-nest-definitivement-pas-une-maladie-pediatrique-145287 []
[13] Gestützt auf Berichte der kommunalen öffentlichen Gesundheitsdienste (GGD)
[14] Heavey L., Casey G., Kelly C. et al. Keine Hinweise auf eine sekundäre Übertragung von COVID-19 von Kindern, die in Irland die Schule besuchen, 2020. Euro Surveill 2020; 25: 2000903
[15] Laut dem australischen Nationalen Zentrum für Immunisierungsforschung und -überwachung https://www.bing.com/search?q=l%E2%80%99Australian+National+Centre+for+Immunisation+Research+and+ Monitoring & Form = QBLH & sp = -1 & pq = & sc = 0-0 & qs = n & sk = & cvid = 4D88315372394AACB2AA964A03900C84
[16] Nationales Zentrum für Immunisierungsforschung und -überwachung. COVID-19 in Schulen – Die NSW-Erfahrung. New South Wales, Australien: Nationales Forschungs- und Überwachungszentrum für Immunisierung
[17] Hildenwall H., Luthander J., Rhedin S. et al. Pädiatrische COVID-19-Aufnahme in einer Region mit offenen Schulen in den ersten zwei Monaten der Pandemie. Acta Paediatr. 2020; 00: 1–3. https://doi.org/10.1111/apa.15432
[18] Helena C. Maltezoua Übertragungsdynamik von SARS-CoV-2 in Familien mit Kindern in Griechenland: eine Studie von 23 Clustern J Med Virol. 2020, 7. August; 10.1002 / jmv.26394. doi: 10.1002 / jmv.26394
[19] Regierungsbehörde von Singapur. COVID-19: Fall in Singapur [Internet]. Singapur, Regierungsbehörde von Singapur. 2020; [Zitiert am 12. März 2020. Verfügbar unter: https://www.gov.sg/article/covid-19-cases-in-singapor [
[20] Weiyong Liu et al.: Nachweis von Covid-19 bei Kindern Anfang Januar 2020 in Wuhan, China N Engl J Med. No. 2020 2. April; 382 (14): 1370 & ndash; 1371
[21] ) Liu Y., Yan LM., Wan L. et al. Virendynamik in leichten und schweren Fällen von COVID-19. Lancet Infect Dis. 2020. https://doi.org/10.1016/ S1473 -3099 (20) 30232
[22] Hong H., Wang Y., Chung HT., Chen CJ., Klinische Merkmale der neuartigen Coronavirus-Krankheit 2019 (COVID-19) bei Neugeborenen, Säuglingen und Kindern, Pädiatrie und Neonatologie, https://doi.org/10.1016/j. pedneo.2020.03.001.
[23] Wu Z, McGoogan JM. Merkmale und wichtige Lehren aus dem Ausbruch der Coronavirus-Krankheit 2019 (COVID-19) in China: Zusammenfassung eines Berichts über 72.314 Fälle des chinesischen Zentrums für die Kontrolle und Prävention von Krankheiten. JAMA 2020; online veröffentlicht am 24. Februar. DOI: 10.1001 / jama.2020.2648
[24] Jonas F. Ludvigsson-Makroanalyse von Covid 19 bei Kindern. Acta Paediatr. 2020 23. März
[25] Entscheidung des Staatsrates vom 2. April 2021 Reisebeschränkungen für geimpfte Personen sind gerechtfertigt
[26] Laetitia Atlani-Duault, Bruno Lina, Franck Chauvin, Jean-François Delfraissy, Denis Malvy Immunevasion Mittel , die wir brauchen einen neuen COVID-19social Vertrag Lancet https://www.thelancet.com/action/showPdf?pii=S2468 -2667% 2821% 2900036-0