il y a déjà près de deux ans ! et énormément diffusé par des internautes y compris à l’étranger. On ne peut pas dire qu’on ne savait pas !
Le Comité Consultatif National d’Ethique a pris des positions qui lui font honneur en rappelant dans de nombreux avis [1] [2] [3] [4]
« Les principes éthiques fondamentaux doivent être respectés ». Il faut éviter que « le confinement, quelle que soit sa justification aux impératifs de santé publique, ne devienne pour ceux qui n’ont plus la liberté de choisir leur cadre et leur mode de vie, une mesure de coercition ».
Et encore : « Faudra-t-il aller jusqu’à contraindre ces personnes en leur appliquant des mesures de contention, physique ou pharmacologique ? « Cette question doit être posée et la réponse doit être le fruit d’une discussion préalable, en y associant des personnes extérieures à l’institution, comme les professionnels des équipes mobiles de gériatrie, ainsi que les proches, sans jamais oublier que l’on peut nier l’humanité de la personne en niant le sens qu’a sa déambulation ».
Et enfin, et peut-être le plus utile en pratique :
« Concernant les familles et les proches aidants qui souhaitent que le résident puisse au moins temporairement les rejoindre à leur domicile, de telles initiatives devraient être encouragées, après avoir bien entendu recueilli l’assentiment du résident et pratiqué des tests permettant de prévenir des risques de contamination intrafamiliale ».
[1] Avis 106 de 2009 sur « Les questions éthiques soulevées par une possible pandémie grippale
[2] Avis 128 de 2018 Enjeux éthiques du vieillissement
[3] Contribution du 13 mars 2020 sur « Enjeux éthiques face à une pandémie
[4] Avis du 30 mars 2020 Réponse à la saisine du ministère des solidarités et de la santé sur le renforcement des mesures de protection dans les EHPADs et les USLD

Décret Rivotril : compassion, euthanasie[1] ou meurtre sur ordonnance ? Versus traitement prometteur par chloroquine, interdite ?
Le traitement du Pr Raoult potentiellement efficace, serait dangereux pour ceux qui sont trop vieux pour bénéficier de soins actifs en cas de Covid ! Mais pas le Rivotril qui les endormira à jamais ! Sortez vos ainés des EHPAD et hôpitaux en urgence.
Ils étaient en prison sans parloir on les met au mitard ! Pour leur bien ? Qui le croira ?
Le Dr Leo Alexander, chef médical consultant américain au procès de Nuremberg, a averti en 1949 :
« C’est à partir de débuts insignifiants que les valeurs d’une société entière peuvent être renversées ». Il a souligné que bien avant l’arrivée au pouvoir des nazis en Allemagne, un changement dans la culture médicale s’était déjà produit « ouvrant la voie à l’adoption d’un point de vue hégélien utilitariste avec une littérature traitant de l’euthanasie et de l’extermination des personnes handicapées dès 1931. »
Un nouveau procès de Nuremberg se profile
Les médecins français et soignants de 2020 sauront-ils mieux résister aux injonctions du pouvoir totalitaire qui se met en place que leurs confrères allemands des années 30, qui appliquèrent la loi hitlérienne visant à euthanasier les handicapés, les fous etc. ?
Comment un soignant peut-il accepter de condamner à une mort rapide un patient avec lequel il converse avec empathie apparente, sous l’ordre de deux médecins différents joints par téléphone qui n’ont pas examiné le malade de chair, d’os et d’âme ?[2] C’est à ces extrêmes qu’on voudrait conduire médecins et infirmiers, qui à court sûr, contraints dans le feu de l’action, et la pression du groupe accepteront pour certains, mais ne s’en remettront jamais à long terme…[3]
Nos aïeux en Ehpad semblent avoir été sournoisement condamnés à mort par une série convergente de circulaires gouvernementales
Une épidémie volontairement non contrôlée : pourvu que ça dure…
Pas de fermeture des frontières, pas de masques ni gels, ni respirateurs en nombre suffisant, pas d’ouvertures de lits ni embauche de personnel, plan blanc bloquant l’activité des cliniques privées depuis près de trois semaines, mais dont les lits restent vides !
« En même temps » une mise en scène théâtrale permet au président de jouer au chef de guerre salvateur (transfert en hélicoptère coûtant plusieurs centaines de milliers € alors que le transport d’un respirateur ne revient qu’à 300 €) …Le plus révélateur de la duplicité gouvernementale pour les français naïfs et/ou bienveillants sont les refus réitérés des propositions d’entreprises pour fabriquer des masques, des respirateurs et d’empêcher les médecins de prescrire l’hydroxy chloroquine aux malades qui en ont besoin alors que ce médicament était en vente libre sans ordonnance jusqu’en janvier 2020 et le décret scélérat d’Agnès Buzyn. Les ARS, les Normes, les contrôles et l’exigence d’un essai randomisé, tout l’arsenal des bureaucrates a été utilisé pour retarder l’arrivée des moyens de lutte contre l‘épidémie, comme durant la drôle de guerre où ils ont retardé la livraison des armes modernes qui ont tant manqué en 40 [4] …
La peur au royaume de Machiavel et le confinement généralisé brutal
Au bout de trois mois de mensonges et de décisions inefficaces, l’excuse d’incompétence n’est plus crédible, ni celle de révision de stratégie. A Wuhan, les chinois ont bâti un hôpital en 15 jours. En Angleterre, et en Espagne des milliers de lits ont été montés en quelques jours. Quand l’Allemagne s’est sentie menacée, A. Merkel a immédiatement réquisitionné des hôtels pour les transformer en hôpitaux, et fait tourner les usines jour et nuit pour fabriquer des respirateurs…
En France, l’épidémie a été favorisée par les décisions gouvernementales inadaptées et incohérentes, telles l’incroyable histoire des masques. Port de masques déclaré inutile[5] pour les forces de l’ordre et la population ordinaire jusqu’au 3 avril 2020 où brutalement le directeur général de la santé demande que tout le monde en porte (« on réévalue la doctrine », il fallait oser ! La peur créée et entretenue 24 /24H par les médias[6], et en particulier leurs médecins préférés comme Karine Lacombe[7], Yazdan Yazdanpanah [8] ou Jean-François Timsit[9], est responsable d’une hystérie collective qui permet au gouvernement d’imposer un confinement généralisé inutile et inefficace sur le plan sanitaire[10] [11], mais qui a le mérite de museler toutes formes d’opposition et de disposer des pleins pouvoirs[12].
Le peuple crédule, quotidiennement lobotomisé par les émissions pseudo-débiles qui véhiculent la propagande gouvernementale ACCEPTE SANS BRONCHER. (Apparemment – l’eau qui bout ?). Les citoyens se croient protégés, alors qu’en même temps, on les laisse se contaminer (ou on favorise la diffusion du virus ?) lors de leurs courses dans les supermarchés en air conditionné (alors que les marchés de plein air sans risque sont fermés !) et dans le RER, pour ceux qui doivent travailler (haut lieu de contamination, les voyageurs serrés comme des sardines, non protégés). Comble de la perversité, soignants libéraux et policiers au contact de la population travaillent sans protection. Si on voulait que l’épidémie puisse prospérer, c’était la meilleure recette. Nos résultats sanitaires du 2 avril 2020 qui nous placent dans le trio des plus mauvais du monde[13] (Italie 12430 morts, Espagne 8189, France 3514 versus Allemagne 732 et Japon 57) le démontrent amplement.
Ainsi, tandis que le premier Ministre ferme les cafés, restaurants, et la plupart des commerces en 4 H (quid des provisions des commerçants ?) le samedi 12 mars, le premier tour des élections a lieu le dimanche. Il annonce le lundi un confinement généralisé pour le mardi midi. Bloqués sur place, sidérés, désireux de donner à leur famille un peu d’espace en campagne, les récalcitrants qui le peuvent seront culpabilisés d’emblée. Mais lorsque quelques semaines plus tard, le président et sa ministre des armées exhiberont leurs joujoux pour transférer à prix d’or des patients Covid19 partout en France, personne ne les accusera de diffusion du virus et d’incohérence, alors que de nombreux lits de cliniques privées, équipés en matériel et personnel restent vacants tout près des hôpitaux saturés.
Confinement politique !
Victoire ! les Gilets jaunes sont bloqués ! Le 49 3 anti-retraites du 29 Février n’a pas le temps d’entrainer de manifestations, CGT FO etc. tous sont neutralisés et terrorisés comme tous, par les annonces mille fois répétées sur les ondes. Les médias oublient totalement la guerre des frontières en Grèce, l’ouverture au marché commun avec le Vietnam par l’UE (en même temps, décidément, que E. M. fait semblant de plaider pour la souveraineté nationale) et l’intégration de nouveaux pays dans l’OTAN. N’oublions pas, la commission européenne planche sur un sujet éminemment urgent, la crêpe bretonne.
Les soignants en grève depuis un an, gazés et tabassés dans les manifestations multiples ne peuvent plus témoigner de la misère de l’hôpital. On les traite de héros chaque soir à 20 H en leur promettant des médailles et encore plus d’applaudissements, alors qu’ils ne voudraient que surblouses et embauches immédiates et que des voisins ne leur demandent pas de déménager. Mais l’ARS Grand Est, région martyrisée par le Covid19 et l’insuffisance de moyens confirme en ce début avril la suppression de 598 postes et de 174 lits. Incroyable !
Dos au mur, pourquoi changer une politique qui tue, surtout les riens (les autres sauf exception, ont accès aux respirateurs et surtout à la chloroquine, comme en témoigne Patrick Pelloux). Les avocats qui se battaient depuis plusieurs mois pour tenter de sauver la Justice et le droit sont également muselés, ainsi que d’autres professions libérales.
Ce confinement prétendument sanitaire est politique et pervers.
Veut-on limiter la diffusion du virus ? Mais pourquoi alors laisse-t-on ouvert les transports bondés, de telle façon que les agents RATP sont particulièrement touchés. Par contre, une femme âgée seule au soleil sur la plage serait dangereuse ! Comme un surfeur, un pêcheur sur un bateau, un joggeur en forêt plutôt que tournant en rond dans une rue pavée ? Une mère qui sort sur autorisation spéciale son enfant autiste, qui reçoit une amende car elle a osé emmener ses autres petits (auraient-ils dû restés seuls ? [14]).
D’innombrables exemples montrent que ce « confinement » est volontairement punitif , humiliant, et vise en réalité à nous conditionner à la soumission à la Stanley Milgram.[15]
Quelle merveille pour le gouvernement que ce vilain virus ? Arrêtons d’être dupes, bisounours, de nous contenter de dessins et de bougies pour honorer les victimes, sans dénoncer les complices du bourreau. Ne sous-estimons pas l’adversaire. L’incompétence affichée, digne des regrettés guignols de l’info dans le jeu de rôle de Sibeth, les décisions contradictoires d’un jour à l’autre avec leurs injonctions paradoxales permanentes constituent une stratégie perverse bien connue « la stratégie du choc ».[16]
Etat d’urgence voté en catimini en 48 H avec quelques députés présents.
L’état d’urgence sanitaire a été officiellement instauré pour « protéger les plus fragiles et en particulier les personnes âgées ». Mais l’analyse des actions gouvernementales réalisées depuis montre qu’en réalité, une des véritables intentions de cette suppression des droits élémentaires du citoyen est « éliminer les vieux » trop coûteux en terme de retraites, de soins. Un des thèmes préférés d’Attali (le mentor d’E. Macron), est l’élimination des retraités après 65 ans (oubliant son âge, mais c’est pour les gueux). La prévision télévisuelle de l’homme C. Barbier, à l’écharpe rouge est glaçante : Macron pourra être réélu en 2022 même s’il traite durement les retraités, car ils ne seront plus là pour voter.
PROCESSUS PROGRESSIF D’ELIMINATION DES AINES ET DES PLUS FRAGILES
A cet effet le gouvernement a édicté une série convergente de lois, circulaires et de décrets qui prévoient et organisent la disparition de nos aïeux hébergés en Ehpad ou même égarés aux urgences des hôpitaux[17]. Rappelons-les par ordre chronologique :
1°) CONFINEMENT IMPOSE A TOUS sauf dérogation le 16 mars 2020, y compris dans les établissements médicaux (hôpital, EHPAD, maternités etc.).
Immédiatement applicable, sans le temps minimum pour rencontrer ses proches, ses kinésithérapeutes, animateurs, bénévoles, au moins pour expliquer, apaiser, s’organiser (téléphones, Skype pour ceux qui pourraient). Rien, un comportement de sauvages comme ceux qui, il n’y a pas si longtemps, faisaient une descente à 4 H du matin pour emmener un communiste, un résistant, un juif. Du jour au lendemain, on prive nos parents de tous contacts, et on s’étonne qu’ils décèdent en grand nombre (non testés). La vie a besoin d’amour pour perdurer et le Covid19 a bon dos[18].
Ce décret instaure le confinement strict, y compris pour des personnes âgées dépendantes des soins physiques, mais aussi psychologiques, soi-disant pour les protéger du virus.
Cet isolement brutal les sépare de leurs familles et les rend ainsi plus vulnérables, les entraine dans un syndrome d’abandon de soi-même vers un syndrome de glissement qui en a déjà probablement tué un bon nombre, avec ou sans l’aide du virus.
Des drames multiples ont déjà été décrits, comme ces couples dont l’épouse venait nourrir son conjoint Alzheimer chaque jour, virée brutalement de l’établissement avec pour seule excuse « on applique les ordres ; « on n’y peut rien ». Ça ne vous rappelle rien ? Vous êtes trop jeunes, peut-être[19]. De plus, on fait signer à ces personnes en état de faiblesse des « directives anticipées » permettant toute intervention, se croyant couvert juridiquement. Soyez prudents, chers collègues, la responsabilité personnelle juridique reste entière, et le parapluie des injonctions Véran sera transitoire, comme son ministère. Le temps de la justice, lui, est long, très long.
Mise au point réconfortante du conseil national d’éthique en ce début avril 2020
Le conseil national d’éthique[20] a parfaitement rappelé :
« L’environnement familial ou amical dont les résidents ne peuvent plus momentanément profiter est pour nombre d’entre eux, le lien qui les rattache au monde extérieur et leur raison essentielle de vivre. Les en priver de manière trop brutale pourrait provoquer une sérieuse altération de leur état de santé de façon irrémédiable et même enlever à certains le désir de vivre ». Et oui le fameux syndrome de glissement…
Et l’on découvre jour après jour un peu plus la perversité tant pour le futur défunt lui-même que pour ses proches de cette mesure qui interdit au mourant de voir sa famille pour ses derniers instants. Pourtant un mourant ne risque plus rien et sa famille peut se protéger par des masques ! Le confinement de nos parents n’est pas une mesure de protection mais une maltraitance, une non-assistance à personne en danger, un abus de faiblesse. On les met en prison en leur supprimant les parloirs !
Comble de la perversité des mesures de confinement (qui les a conçus et rédigés ?), les familles ont interdiction de voir le corps de leur défunt et pire encore, de l’enterrer en se soutenant les uns les autres au cimetière. Les premières contraventions de familles dans ces circonstances ont scandalisé les internautes et actuellement seules quatre personnes seraient autorisées. Insupportable détournement d’une mesure soi-disant sanitaire. Humiliation d’un peuple qui a osé résister depuis trop d’années au goût des gouvernants en place depuis 2012 (E. M. secrétaire général adjoint de l’Elysée sous Hollande, puis ministre de l’économie puis président et O. Véran et J. Salomon conseillers de M Touraine ministre de la santé responsable de l’épouvantable Loi de Santé 2016). Revanche contre les Gilets Jaunes !
2°) Absence de fourniture de matériel barrières (masques, gants, blouses à usage unique), de tests aux soignants, policiers, conducteurs de métro etc. facilite leur contamination et les transforme (à leur insu et à leur péril) en agents de diffusion du Covid19 parmi leurs pensionnaires lors des soins ou après des contrevenants et voyageurs. Non testés même s’ils présentent des signes très évocateurs, donc non confinés et contaminants.
Est-ce un hasard si les promesses de fournir des masques aux EHPAD n’ont presque jamais été tenues et ne le sont toujours pas ? Ce sont les bonnes volontés qui tentent de les aider. A quoi servent nos impôts ? Sans honte, Darmanin, ministre de l’économie, et Hirsch, directeur de l’APHP font des quêtes, comme malheureusement Bern pour notre patrimoine aussi mal en point que notre système sanitaire.
Les mesures contre les personnes âgées se durcissent avec les consignes, la loi n° 2020-290 du 23 mars 2020 et plus encore le décret du 28 mars signé E. Philippe et O. Véran
Ils prévoient, organisent et facilitent l’euthanasie des personnes âgées (âge non précisé : 60 ,65, 75 ?) par injection intraveineuse d’un médicament contre-indiqué dans les détresses respiratoires. Injection qui va donc endormir le patient, aggraver son asphyxie et le mener à la mort. Le consentement éclairé, est absent[21] de même que le simple choix du patient en abus de faiblesse.
De la compassion pour les malades en grande détresse respiratoire ?
Certes, certains partisans de l’euthanasie, et les responsables de ce décret plaideront la compassion pour des malades en grand danger, en détresse respiratoire. Bien, mais pourquoi inclure parmi les « bénéficiaires éventuels de ce décret, les patients encore en bon état, mais exclus des soins hospitaliers et/ou de réanimation, sur simple décision de médecins au téléphone qui n’auront ni vu ni examiné le malade et le condamneront en raison de son âge et de ses antécédents médicaux. Sauf si c’est Michet Drucker comme le disent fort justement les twittos. Aux soignants de faire le sale boulot, injecter la seringue prête dans la chambre. Comme souvent diront-ils, et ne s’en remettront pas toujours.
Compassion, oui mais pour les malades qui souffrent le martyre, pas pour ceux qui pourraient un jour, peut-être, souffrir ce martyre comme nous tous et qui actuellement perdent des chances de survie en leur refusant une chance avec le schéma de l’équipe Raoult.
Même les militants de l’euthanasie sont choqués
Mais comme le font remarquer de nombreux pro-euthanasie, celle-ci doit être la décision du patient et non de l’entourage soignant. L’état d’abus de faiblesse des personnes âgées, isolées, déprimées par l’absence d’environnement familial et amical, laissent largement douter d’un consentement véritablement éclairé lors des directives anticipées qu’on leur demande de remplir ces jours-ci à toute vitesse. Pourquoi ?
Mise en danger juridique des soignants et médecins. Valeur très relative des directives anticipées signées dans ces conditions de confinement
En tous cas, ces directives sans délai de réflexion réel, sans accompagnement véritable ne seraient que fausse protection des soignants en cas de plainte juridique des proches. Collègues, infirmiers, soyez prudents et protégez-vous aussi, ce décret qui semble pour certains juristes, illégal car contraire à la loi Leonetti, pourrait bien être abrogé par les recours au conseil d’Etat qui vont se multiplier.
3°) Refus d’admettre en réanimation les plus de 70-75 ans, quel que soit leur état physiologique, peut-être en partie pour camoufler l’insuffisance majeure de lits et de respirateurs qui résulte des politiques sanitaires désastreuses des dernières années. Argument douteux quand on connait le nombre de lits vides en établissements privés dotés du nécessaire pour prise en charge de malades lourds et réservés par les ARS en fonction de leur bon vouloir. Directive d’inspiration bureaucratique plus que médicale, car les médecins ne raisonnent jamais en âge absolu, mais bien « physiologique » en fonction de plusieurs caractéristiques de la personne.
4°) Interdiction d’adresser en consulter et d’admettre à l’hôpital public les malades des Ehpad suspects de Covid19 ou des personnes à domicile âgées. Tentez votre chance pour vos proches (en les sortant préalablement pour leurs « derniers jours » chez vous) en consultant directement aux urgences des hôpitaux privés, pour ceux auxquels l’ARS n’a pas supprimé cette compétence. Et n’appelez ni SAMU ni pompiers auxquels l’état impose d’emmener le patient directement en public et seulement en public (même si vous êtes suivi depuis des années par un médecin ou chirurgien) dans un de ces hôpitaux privés. Si besoin, demandez une ambulance privée.
Tel est l’état du système de santé français complètement déséquilibré et entièrement sabordé par l’Etat via les ARS, les libéraux étant complètement sous la coupe de la technocratie. Il n’y a pas à proprement parler de système privé en France.[22] [23] [24]
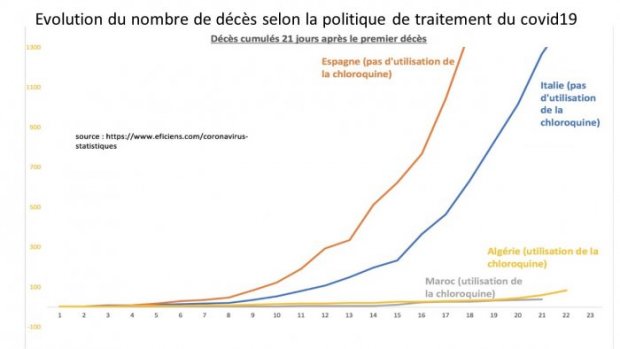
5°) Décret du 26 mars empêchant la prescription de chloroquine dans ces établissements et interdiction aux médecins généralistes de ces établissements de les traiter par l’association Chloroquine-Azithromycine (sous prétexte de leur éviter des traitements dangereux !), alors que cette association est donnée depuis longtemps, sans complications notables aux femmes enceintes en zone d’endémie palustre pour prévenir paludisme et infections.
Quel risque chez des patients abandonnés que l’on estime condamnés ? La chloroquine, potentiellement efficace, serait-elle plus dangereuse pour eux que le Rivotril injectable à visée de sédation profonde définitive, puis mort ? De fait, les médecins résistants peuvent tout de même les mettre sous azithromycine en vente encore libre sur ordonnance (pour combien de temps) et/ ou sous ciflox qui semble avoir les mêmes effets que l’azithromycine et peut-être pas en rupture de stock. Collègues, battez- vous, battons-nous ensemble à travers des pétitions bien reçues comme celle du dr Eric Menat [25].
https://www.petition-chloroquine.fr/ signez, diffusez.
Merci pour les patients dont certains certes auraient guéri spontanément, mais les autres ? Ne pas vouloir traiter sous ce prétexte nous semble remettre en question toute la médecine « préventive » ou précoce, et singulièrement les vaccinations qui ne sont pas données à des malades mais à des bien portants pour leur éviter une possible maladie, comme d’ailleurs la chloroquine est donnée pour éviter le paludisme…
6°) Ordre de maintenir les pensionnaires infectés dans l’établissement (afin qu’ils contaminent un maximum de leurs compagnons d’infortune ?).
Le 30 Mars, devant le scandale difficile à étouffer, le ministre demande à isoler préventivement chaque patient dans sa chambre. Plus de visites, plus de bénévoles déjà depuis deux semaines et maintenant plus de contacts avec les autres pensionnaires, temps soignant très court.
Ils étaient en prison sans parloir on les met au mitard ! Pour leur bien ? Qui le croira ?
A peine besoin du Covid19 et/ou du Rivotril pour les achever. Cette prison de fin de vie pour personnes handicapées qui, souvent, ne peuvent se lever, est une aberration majeure, une maltraitance monstrueuse. Qui a pu donner des consignes pareilles ? Quels médecins peuvent assumer cette mort à petit feu dans un lit d’une chambre fermée dont on ne peut sortir même pour les toilettes… Finalement quand on lit cet arrêté, on peut se demander si Edouard Philippe n’a pas voulu donner une « mort miséricordieuse » à la Hitler avec son Rivotril, pour les mettre rapidement dans un coma irréversible ?
8°) Fourniture du poison (Rivotril injectable) autorisé par le décret du 29 mars pour une période exceptionnelle
INCITE LES MEDECINS ET SOIGNANTS A ACCELERER LA FIN DE VIE CHEZ LES PATIENTS QU’ ILS ESTIMENT NE PAS POUVOIR PRENDRE EN CHARGE (faute de lits ou de probabilité suffisante de les guérir !)
SEULS, SANS CONSENTEMENT DU PATIENT, NI DE SA FAMILLE QUI NE LE REVERRA PAS
Une internaute : « on leur a amené ma grand-mère consciente, un peu gênée sans plus, ils nous ont rendu un cercueil fermé et l’interdiction de l’accompagner à plusieurs dans sa dernière demeure ». Nous pourrions vous en transcrire des centaines.
Ce décret scélérat autorise la prescription de Rivotril [26] sous forme injectable dans ces établissements, aux malades infectés[27] ou supposés tels (pas de test !). Le Rivotril injectable, puissant inhibiteur respiratoire est, selon la notice, contrindiqué dans les détresses respiratoires. C’est clair ! « Par dérogation à l’article L. 5121-12-1 du code de la santé publique, la spécialité pharmaceutique Rivotril® sous forme injectable peut faire l’objet d’une dispensation, jusqu’au 15 avril 2020, par les pharmacies d’officine en vue de la prise en charge des patients atteints ou susceptibles d’être atteints par le virus SARS-CoV-2 dont l’état clinique le justifie sur présentation d’une ordonnance médicale portant la mention “Prescription Hors AMM dans le cadre du covid-19” ». Le ministre pousse la générosité à rembourser le médicament à 100 % , 4 € plus généreux que les Chinois qui font payer la balle aux familles des condamnés à mort.
9°) Fourniture du mode d’emploi complet du médicament létal : « le médecin se conforme aux protocoles exceptionnels et transitoires relatifs, d’une part, à la prise en charge de la dyspnée et, d’autre part, à la prise en charge palliative de la détresse respiratoire, établis par la société française d’accompagnement et de soins palliatifs »[28].
Un « protocole » imposé aux cliniciens désemparés devant tant de violation du serment d’Hippocrate
Les médecins reçoivent au début de leur garde une fiche conseil pour la prise en charge des patients Covid [29] . Injonction mortifère pour « euthanasie », mais sans consentement éclairé de l’intéressé, ni demande préalable à la famille, contraire à la loi Leonetti et même aux désirs des partisans de l’euthanasie qui la souhaitent toujours décidée par le patient lui-même.
Les fiches détaillent les étapes à suivre selon la gravité du tableau clinique[30] . Pour un malade souffrant d’une légère dyspnée :
ETAPE 1 « Anticiper une aggravation éventuelle avec le soignant
1- préparer le matériel – Oxygène prêt à l’emploi si possible (HAD, prestataires privés) – Disponibilité des médicaments (et des soignants en cas de prise en charge à domicile) – Matériel de protection des soignants
2- rédiger des prescriptions anticipées qui autorisent l’infirmière à débuter l’administration si aggravation.
3- préparer les traitements médicamenteux nécessaires à la réalisation de la sédation, dans le poste de soin. En cas de nécessité préparer les seringues à l’avance et les conserver dans la chambre du patient. Il faut alors étiqueter la seringue avec le nom du patient + le contenu de la seringue + la date et l’heure de préparation + le nom du préparateur
DANS TOUS LES CAS : Se renseigner sur les organisations et ressources en soins palliatifs mises à disposition sur son territoire de santé :
Patient pour lequel il a été statué qu’une prise en charge en USI ou réanimation ne serait pas entreprise [31]
Patient présentant des facteurs de risque de forme sévère (cancer, pathologie chronique sous-jacente, insuffisance cardiaque ou rénale…)
REPERER les premiers signes de DYSPNEE[32] (..) »
ETAPE 1 : ANTICIPER L’AGGRAVATION EVENTUELLE DE L’ETAT RESPIRATOIRE AVEC LE PATIENT
- EVALUER LES SYMPTOMES : dyspnée, encombrement, angoisse, douleur.
- 2- INFORMER LE PATIENT s’il est communiquant et de façon adaptée sur la possibilité du recours à une sédation en cas de détresse respiratoire asphyxique. Rechercher son consentement si possible et informer la personne de confiance ou les proches.
- RECHERCHER D’EVENTUELLES DIRECTIVES ANTICIPEES
- TRACER LES INFORMATIONS dans le dossier médical et noter la prescription anticipée dans l’observation médicale et dans les transmissions soignantes »
Telles sont les consignes de la fiche médicale portant sur le premier stade, dont des patients « bien portants ». Les fiches suivantes portent sur les patients en détresse respiratoire avérée
ETAPE 2 : Face à une détresse respiratoire, endormir rapidement le patient pour lui éviter une sensation d’étouffement
- PRINCIPES DE TRAITEMENT [33]
- REPERER LADETRESSE RESPIRATOIRE ASPHYXIQUE :
PATIENT COMMUNIQUANT : sensation d’étouffement avec angoisse massive/agitation et sensation de mort imminente
PATIENT NON COMMUNIQUANT : FR> 30/min, agitation, utilisation des muscles respiratoires accessoires (élévation de la clavicule durant l’inspiration), respiration paradoxale (dépression abdominale durant l’inspiration), battement des ailes du nez, râles de fin d’expiration, faciès de peur.
REPERER les premiers signes de DYSPNEE : (Covid 19 : Risque de dégradation rapide de l’état respiratoire) [34]
Des consignes pour les soignants, outre le protocole technique que nous ne détaillerons pas ici, sont rédigées dans cette fiche[35].
Faire le tri du stock de malades, selon l’expression du Président
Comme l’a simplement résumé Corso di saluti [36] : « s’il n’y a plus de place pour prendre les patients en détresse respiratoire, on demandera aux médecins de ville de « faire le tri » en amont, en administrant directement des traitements palliatifs à ces patients ».
Le plus choquant dans ces fiches détaillées pour les médecins et infirmiers est le détail des indications initiales alors que le patient respire normalement ET qu’on lui demande de fait d’accepter l’euthanasie en cas d’aggravation. Préventivement. Froidement.
Les fiches se poursuivent avec les protocoles techniques pour malades en détresse respiratoire graves qui ne sont plus admis en réanimation depuis quelques jours alors que des lits sont disponibles dans des cliniques privées qui ont signifié leur accord pour les accueillir.
ASSASSINAT AVEC PREMEDICATION SUR INJONCTION DE L’ETAT
Il s’agit donc bien de la préparation de la mise à mort préméditée, programmée, de vieillard qui aurait le malheur d’être dans un EHPAD, à l’hôpital, ou même à domicile et qui aurait l’imprudence d’appeler chez lui pour n’importe laquelle pathologie pulmonaire un médecin complice de ce programme criminel.
Nous parlons de crime parce qu’il ne s’agit pas là d’un arrêt de traitement inutile (on ne les traite pas), ni de mettre fin à des souffrances (qui n’existent pas encore) puisque cet empoisonnement est anticipé. Et en cas de résistance imprévue du sujet au premier cocktail, la fiche conseille de doubler les doses et/ou de recourir aux autres drogues connues dans les euthanasies souhaitées ou subies depuis 20 ans.
Nous nous garderons de vous donner la recette de ce cocktail rappelé aux médecins de garde dans la fiche de la société de soins palliatifs et accompagnement.
8°) Ce même décret autorise l’extension des morgues dans ces établissement sans demande de permis de construction préalable, pudiquement appelés « locaux destinés à l’entreposage » afin d’accroître la capacité des morgues existantes des établissements auxquels les ARS soi-disant incapables de fournir des masques de protection ont déjà fourni des housses mortuaires. Pourquoi tant de prévisions pour cadavres si comme LCI tente de le faire croire ce jour dimanche 5 avril, ce décret ne visait pas la disparition de nombreux vieillards, pas toujours si vieux … puisque bons à travailler selon le dernier projet de retraites.
9°) Réquisition d’entrepôts réfrigérés à Rungis pour entreposer les corps. Avec l’idée fameuse de rejoindre le plus gros marché alimentaire de France. Ils ont toujours des idées…
DES ANTECEDENTS PEU GLORIEUX AU DECRET RIVOTRIL SIGNE PHILIPPE-VERAN
« N’est-ce pas l’exigence de la charité : délivre ceux que tu ne peux guérir ! » LA MORT MISERICORDIEUSE selon Hitler …
Afin que chacun discerne clairement la société dans laquelle nous nous dirigeons à grands pas, si une réaction majeure à ce décret n’apparait pas très rapidement, nous rappellerons quelques épisodes de l’ascension d’Hitler et de sa marche vers l’horreur à l’aide de quelques moments cruciaux (lire le développement de Wikipédia sur le sujet). Il s’agit ici de rappeler le génocide des malades par Hitler, en parallèle au génocide possible des vieux malades engagé par le décret #RIVOTRIL du 26 Mars 2020 en France.
Le drame global de la Shoah ne sera pas détaillé ici, mais chacun doit bien penser que mettre le doigt dans l’engrenage est un risque réel…
Petit rappel :
« Euthanasie des enfants sous le Troisième Reich : meurtre d’enfants et d’adolescents handicapés organisé par le régime nazi, sous le Troisième Reich de 1939 à 1945.
Ce programme, initié et dirigé depuis la Chancellerie du Führer et sur ordre d’Hitler, précède chronologiquement celui de l’Aktion T4, et implique un grand nombre d’« établissements pédiatriques spécialisés » sur le territoire du Reich. Plus de 5 000 enfants ont été victimes de ce programme, et peu de ses responsables sont poursuivis pénalement après-guerre ». [37] [38]
Le mythe du soulagement de la souffrance des enfants, utilisé déjà par les nazis
« Les demandes de malades incurables ou de personnes sévèrement blessées, qui priaient d’être délivrées de souffrances trop dures à porter pour eux, arrivaient de plus en plus souvent, et ce environ six mois avant que la guerre n’éclate.
Ces demandes étaient particulièrement tragiques, car les médecins ne pouvaient les satisfaire en raison des lois existantes. Comme notre office était justement là, comme on nous le répétait souvent, pour traiter sur ordre d’Hitler les cas qui ne pouvaient être résolus légalement, le docteur Hefelmann et moi-même nous sommes sentis obligés de transmettre au docteur Brandt un certain nombre de ces cas, en le priant de solliciter d’Hitler ce qu’il convenait de faire. Le docteur Brandt répondit bientôt qu’il était possible d’accéder à de telles demandes, si l’on pouvait s’assurer que le médecin traitant du patient ainsi qu’une commission médicale, qui restait à créer, s’entendaient sur le caractère incurable de la souffrance »[39]
Lecture difficile à supporter.
DEROULEMENT DU PROGRAMME D’EUTHANASIE DES MALADES SOUS HITLER
« Euthanasie » des enfants de 1939 à 1945,
« L’euthanasie » des adultes de 1940 à 1945 :
« L’Aktion T4 » programme centralisé d’assassinat par le gaz, de janvier 1940 à août 1941,
« L’euthanasie » par les médicaments, ou par une sous-nutrition contrainte, pratiquée de façon plus décentralisée de septembre 1941 jusqu’en 1945,
« L’euthanasie » des invalides et des détenus, connue sous le nom « Aktion 14f »[40] d’avril 1941 à décembre 1944
L’Aktion Brandt prend place de juin 1943 à 1945[41]. Le nombre des victimes de ce programme de « guerre contre les malades » est estimé à 260000 personnes[42].
« Aktion T4 [43] nom donné, après la Seconde Guerre mondiale, à la campagne d’extermination d’adultes handicapés physiques et mentaux par le régime nazi, de 1939 à août 1941 (70 000 à 80 000 victimes) ».
Le nazisme ne tombe pas du ciel, préparé par plusieurs décennies de propagande d’eugénisme depuis les années 1880
L’extermination ne tombe pas du ciel, elle est précédée par une mise en condition de la population et des politiques pour un eugénisme actif qui fleurit aux USA et en Europe dès les années 1880. Dès 1895, le juriste allemand Adolf Jost, dans son ouvrage Le Droit à la mort, plaide en faveur de « mises à mort médicales ». En Allemagne Alfred Ploetz, fondateur en 1905 de la Société pour l’hygiène de la race, estime qu’il faut arrêter les soins aux malades alcooliques, vénériens ou issus d’unions consanguines, car ils sont « contre-sélectifs », en leur permettant de se reproduire et de maintenir ainsi des tares héréditaires dans le corps social15 ; il conseille aux médecins de tuer les nouveau-nés chétifs et malformés ».
« En 1920, l’ouvrage Die Freigabe der Vernichtung lebensunwerten Lebens (L’autorisation de l’annihilation de la vie dénuée de valeur) de Karl Binding et Alfred Hoche propage en Allemagne les concepts de « semi-humains », « esprits morts », « avariés » et « existences superflues ». Parmi les raisons évoquées, et par la suite reprises par les nazis, figurait la nécessité d’éviter de dépenser un argent qui pourrait servir autrement à des fins « productives[44] » Dans cet ouvrage crucial selon Lifton19, les auteurs estiment que l’euthanasie forcée est une action compassionnelle et conforme à l’éthique médicale.
Lors de la publication de l’ouvrage, l’écrasante majorité des médecins allemands rejette l’euthanasie, mais l’idée de mettre à mort des malades se propage dans l’opinion : en 1922, une revue de droit pénal publie un projet de loi sur la suppression des malades mentaux, et en 1925, une enquête menée auprès de théologiens fait apparaître que certains d’entre eux estiment inutile d’aider médicalement les enfants attardés ».
1933, « la Conférence internationale d’hygiène mentale, tenue à Paris, se déclare unanimement favorable à toutes mesures empêchant la naissance « des anormaux et des tarés ». En juin 1933, Hitler assiste à une séance du Congrès annuel de la Société internationale de biologie criminelle, tenue à Hambourg, où sont présentés les bons résultats des lois de stérilisation au Danemark. Cette séance convainc Hitler d’appliquer de telles lois, mais renforcées et contraignantes, en Allemagne (loi du 14 juillet 1933) ». [45]
Les antécédents de l’histoire actuelle en France
Comme en Allemagne lors de l’ascension d’Hitler, le décret d’E Phillipe ne tombe pas du ciel malheureusement. Nous écrivions déjà en 2013 [46] : « L’euthanasie, ou la réduction radicale des dépenses de santé.
« 3,1 % des décès font suite à un acte visant délibérément à abréger la vie, par un arrêt du traitement ou une intensification de la sédation. Dans 0,8 % des décès, des médicaments ont été administrés afin de donner la mort (dont 0,2 % seulement à la demande du patient). Aujourd’hui illégale, l’euthanasie est pratiquée et dans un nombre significatif de cas sans la demande du patient selon l’Ined. (…)
Si on « aide « quelqu’un à mourir, ce ne peut être qu’un choix longuement pesé et le risque moral, médicolégal et éthique doit persister et être assumé, seul rempart à la banalisation du meurtre. Il ne faut pas banaliser le fait de « tuer » dans notre société et achever un mourant est bien « tuer ». Si on passe la limite sans même sans apercevoir, la déliquescence de la société et son humanité sont en jeu. La porte est rouverte aux wagons de bestiaux, aux camps pour handicapés ou opposants, aux expériences médicales sur ces « sous hommes » déchets humains selon l’expression des années 1930 pour les cancéreux incurables, voir à l’extermination de catégories gênantes, bref au fascisme qui rode toujours » car « le ventre est toujours fécond d’où nait la bête immonde[47] »
Déjà trop d’euthanasies en France, la mort précipitée dans un cas sur deux ! Ce nombre important de fins de vie « accélérées » dont un nombre non négligeable sans l’accord du patient même conscient interpelle.
Les gouvernements, les soignants, voire les familles ont pris l’habitude de décider de ce qui est bon pour le malade. On a l’habitude d’entendre dans les réunions hospitalières qui se permettent de décider de la vie ou de la mort des individus au nom d’une collégialité toute puissante : « cette vie ne vaut pas la peine d’être vécue » (et la leur ?). Ou bien « pourquoi réanimer cette enfant handicapée ? » (Faits quotidiens dans les hôpitaux). Faut-il avoir un QI minimum pour avoir le droit de vivre, de rire, de jouer, d’aimer et d’être aimé ? »
N’est-ce pas cette dérive devenue banale qu’on voit se formaliser dans ce décret et cette fois-ci à grande échelle ?
Sur les causes de cette dérive mise sur le compte de la compassion, nous évoquions des raisons pas si nobles en faveur de l’euthanasie motivant peut-être certains de ses promoteurs.
Les soins palliatifs sont encore trop coûteux. Les hôpitaux sont « encombrés » de patients vieux, fatigués, malades peut-être incurables (cela est vite décrété et souvent au moins partiellement faux). Les établissements hospitaliers sont en déficit. Il faut réduire les coûts, donc les hospitalisations, d’autant que les moyens ou longs séjours nécessitent beaucoup de personnel soignant et que ce sont les emplois qui coûtent chers.
Alors accélérer les fins de vie en le présentant comme un choix humain et compassionnel, n’est-ce pas une belle idée de gestionnaires, inavouable dans ses raisons réelles à la population. Les citoyens ne le découvrent que lorsque leur proche est en cause. Et encore seulement les plus vigilants qui ne se laissent pas tromper par le discours de compassion apparente.
UNE NOTE D’ESPOIR
Parmi les journaux, l’Obs[48] et Corse matin se sont jusqu’ici saisi du problème. Les grands médias n’ont guère réagi ni informé sur les raisons réelles et les conséquences pratiques de ce décret. Les réseaux sociaux sont heureusement plus actifs et de nombreux médecins hurlent à la honte de ce viol du serment d’Hippocrate et quelques radios [49].
Ce 5 avril 2020, devant la stupeur et l’indignation suscitées par le décodage des finalités de ce décret, le gouvernement a mobilisé tous ses moyens de désinformation dont LCI vient de donner un bel exemple en prétendant que ce décret aurait : « pour objectif la prise en charge palliative des patients confrontés à un état asphyxique et ne pouvant être admis en réanimation ou pour lesquels une décision de limitation de traitements actifs a été prise. »
Ce qui confirme en fait exactement ce que nous dénonçons : ils sont victimes d’une décision de non-admission en réanimation (parce que la réanimation manque de lits obligeant les réanimateurs à faire un tri inhumain).
Cette pseudo mise au point essaie de cacher qu’il s’agit d’une euthanasie active et non pas d’une limitation des traitements actifs. En effet, l’interdiction d’usage d’emploi de la chloroquine dans les stades précoces par le gouvernement,fait qu’il n’existe pas en France [50] de traitement actif du Covid19. Le Rivotril injectable n’est pas un traitement du Covid19, mais un puissant dépresseur respiratoire d’ailleurs officiellement contre-indiqué en cas de difficultés respiratoires ce qui est exactement le cas des infections à Covid19 qui se compliquent. Il vise à la sédation profonde et définitive, et donc de décès.
Et le Dr Gavazzi prétend justifier l’euthanasie active (injection de Rivotril) par le risque de complication lors des soins de réanimation : « Aujourd’hui, on sait que la durée d’intubation pour les malades du Covid-19 est d’environ 21 jours. C’est une technique très invasive pour le patient, avec de nombreuses prises de sang et de nombreuses autres procédures de soins invasives potentiellement douloureuses. Cela peut entraîner d’importantes complications et des conséquences lourdes, explique encore le Dr Gavazzi. Oui, des personnes ne peuvent pas supporter ce protocole de soin », mais la mort par Rivotril n’est-il pas pire que des complications éventuelles ?
Le Comité Consultatif National d’Ethique a pris des positions qui lui font honneur en rappelant dans de nombreux avis [51] [52] [53] [54]
« Les principes éthiques fondamentaux doivent être respectés ». Il faut éviter que « le confinement, quelle que soit sa justification aux impératifs de santé publique, ne devienne pour ceux qui n’ont plus la liberté de choisir leur cadre et leur mode de vie, une mesure de coercition ».
Et encore : « Faudra-t-il aller jusqu’à contraindre ces personnes en leur appliquant des mesures de contention, physique ou pharmacologique ? « Cette question doit être posée et la réponse doit être le fruit d’une discussion préalable, en y associant des personnes extérieures à l’institution, comme les professionnels des équipes mobiles de gériatrie, ainsi que les proches, sans jamais oublier que l’on peut nier l’humanité de la personne en niant le sens qu’a sa déambulation ».
Et enfin, et peut être le plus utile en pratique :
« Concernant les familles et les proches aidants qui souhaitent que le résident puisse au moins temporairement les rejoindre à leur domicile, de telles initiatives devraient être encouragées, après avoir bien entendu recueilli l’assentiment du résident et pratiqué des tests permettant de prévenir des risques de contamination intrafamiliale ».
Relisez ces avis ; méditez -les ; et si vous le pouvez, sauvez vos êtres chers, en les sortant des établissements que le gouvernement transforme petit à petit en abattoirs, et en attendant que raison ne revienne sous la pression populaire.
[1] Source : Organisation Mondiale de la Santé (OMS/WHO) Rapport 804 du comité d’experts
– Il est éthiquement justifiable de ne pas mettre en œuvre ou d’arrêter des mesures destinées à prolonger la vie qui ne sont pas en accord avec les désirs du malade, quand de telles mesures ne peuvent inverser l’évolution de la maladie mais seulement prolonger l’agonie.
– Il est également justifiable, sur le plan éthique, pour des médecins, après consultation avec des membres de la famille, des tuteurs ou des mandataires préalablement désignés par un malade, de prendre de telles décisions au nom de patients inconscients ou incapables.
– Des médicaments à des doses requises pour supprimer la douleur et d’autres symptômes ne peuvent pas être refusés seulement parce qu’ils pourraient abréger la vie d’un malade.
– L’euthanasie (hâter la mort de façon active par des médicaments) ne doit pas être légalisée.
[2] Cf témoignage poignant sur twitter du 3 04 2020 @princedelamour, petite vidéo vue des milliers de fois.
[3] Nous avons vécu cela avec les enfants cancéreux de Garches, brutalement extirpés de leur milieu soignant aimant par la fermeture brutale, accompagnée de CRS (déjà en 2014), le personnel soignant contraint au silence sous peine de sanctions par le petit chef issu d’un ministère et reconverti à l’APHP. Les séquelles chez ces personnels furent lourdes, en termes de dégoût, désinvestissement et abandon de la carrière. Cf Neuf petits lits sur le trottoir, N Delepine éditions Fauves 2014, récit d’un drame collectif abominable.
[4] Comme les chasseurs Dewoitine 520 qui n’avaient pas été munis de leurs mitrailleuses en mai 40 ! Ce chasseur a montré sa supériorité sur le Messerschmitt 109, avion allemand gloire de la Luftwaffe. Malheureusement seulement 37 exemplaires avec mitrailleuses furent livrés avant la débâcle, alors que mille auraient pu l’être dont beaucoup saisis par les allemands ont été distribués aux alliés de l’Axe.
[5] Interrogée le 4 mars 2020 sur France Inter la porte-parole du gouvernement Sibeth Ndiaye a répondu fermement : « non, on ne doit pas acheter de masques, et d’ailleurs on ne peut pas en acheter puisque nous avons donné des instructions ».
[6] Dont les propriétaires milliardaires possèdent aussi des actions de Gilead, Abbvie ou Sanofi
[7] Aucune des chaînes qui la programme ne précise que la collaboration avec ces labos, lui a apporté plus de 150.000 $ en 5 ans. Ecoutez Sud radio émission André Bercoff : Gérard Delepine du 27 mars 2020, et ce dans la violation de la loi de 2011.
[8] Très lié à AbbVie, Bristol-Myers Squibb, Gilead, MSD, Pfizer, Johnson & Johnson, and ViVi Healthcare
[9]Lié à Maat Pharma, Merck, Bayer pharma, Medimune, Gilead, VenatoRx, Nabriva, Paratek
[12] Et vote d’une loi d’urgence sensée être sanitaire et qui casse ce qui reste du code du travail, sans manifestation possible car confinement. Jusqu’à quand ?
[13] Italie, Espagne, France pays qui les premiers ont confiné leur population saine
[14] Contestation pénale prévue et remboursement possible ? cf. PlainteCovid.fr diffusée par Bruno Gaccio collective et déjà des milliers de plaintes
[15] « Soumission à l’autorité Stanley Milgram et le film la Vague.
[16] La stratégie du choc – Naomi Klein, octobre 2013 Essai (Poche)
[17] Que beaucoup d’entre eux évitent depuis plusieurs années, vu la tendance qui devient plus visible actuellement.
[18] Partout dans le monde en particulier USA et Italie, les morts seraient tous attribués au Covid19, alors que décédés avec le Covid19, ou même sans, en vue d’alimentation de la peur, et de subventions possibles (USA : tous les frais liés au virus seront pris en charge par l’Etat, promesse de Trump).
Dans le sud de l’Italie ce ne serait que 12% liés directement au virus, sous réserve de ces chiffres. A suivre.
[19] « Je n’ai fait qu’obéir aux ordres » était l’argument le plus fréquemment avancé par les gardiens de camps de concentration nazis pour fuir leurs responsabilités lors des procès de Nuremberg. Deux médecins furent pendus.
[20] Avis du 30 mars 2020 Réponse à la saisine du ministère des solidarités et de la santé sur le renforcement des mesures de protection dans les EHPADs et les USLD
[21] Il ne s’agit donc pas d’une euthanasie au sens juridique, mais bien d’un meurtre. Définition juridique de l’euthanasie : se définit comme un suicide aidé par un tiers, tiers qui est le plus souvent un médecin. Elle traduit un désir de contrôle de la phase terminale de sa vie. Ses partisans estiment que le patient a le droit de mettre fin à sa vie si celle-ci est devenue intolérable. https://www.cairn.info/revue-etudes-sur-la-mort-2001-2-page-69.htm
[22] Quant aux suppléments d’honoraires que certains vont mettre en exergue, les plus élevés et excessifs se voient dans les hôpitaux publics et la médaille d’or à quelques médecins de l’aphp, souvent les mêmes que ceux qui ont de puissants liens d’intérêt. Ceci est une autre histoire.
[24] Soigner ou obéir N et G Delépine ; éditions Fauves 2016
[25] « Je sais bien que les gouvernements ne tiennent jamais compte des pétitions.
Mais sait-on jamais. Certains d’entre vous peuvent être intéressés à faire connaître leur point de vue.
Personnellement, je l’ai fait. Écoutez la vidéo, et prenez votre décision en votre âme et conscience.
A l’heure où nos structures médicales sont saturées, pourquoi interdit-on aux médecins de terrain de traiter, comme ils l’ont toujours fait, au cas par cas, leurs patients qu’ils connaissent bien, avec des médicaments dont ils connaissent parfaitement les contre-indications éventuelles et les dosages ?
195 000 en 24 heures, je n’ai personnellement jamais vu ça… » Dominique Delawarde
[26] Puissant calmant et dépresseur respiratoire totalement déconseillé aux personnes qui ont du mal à respirer
[27] Décret no 2020-360 du 28 mars 2020 complétant le décret no 2020-293 du 23 mars 2020 prescrivant les mesures générales nécessaires pour faire face à l’épidémie de covid-19 dans le cadre de l’état d’urgence sanitaire
[28] « Fiche conseil-urgence sanitaire patients Covid+ prise en charge des détresses respiratoires asphyxiques à domicile ou en EHPAD rédigée par la Société dite savante d’accompagnement et de soins palliatifs.
[29] « Ces propositions ne sont en aucun cas destinées à être appliquées dans d’autres circonstances que celles que nous rencontrons, déjà aujourd’hui pour certains et peut-être demain pour d’autres, liées à ce contexte dramatique d’épidémie de COVID19 » .Travail coordonné par Pr Morel (président conseil scientifique de la SFAP), Pr Guirimand, Dr Michenot, Dr Sahut-d’Izarn.
[30] « Prise en charge des détresses respiratoires asphyxiques à domicile ou en Ehpad »
[31] C’est là que le bas blesse le plus ! Qui décide ?
[32] Covid 19 :Risque de dégradation rapide de l’état respiratoire) Gêne respiratoire rapportée par le patient, évaluée sur une échelle de 0 (je respire normalement ) à 10 (j’ai une gêne maximale) ou par une échelle verbale simple (gêne respiratoire absente/ légère / modérée / sévère / très sévère) Patient non communiquant : FR>24/min ou utilisation des muscles respiratoires accessoires (élévation de la clavicule durant l’inspiration) ou respiration paradoxale (dépression abdominale durant l’inspiration)
Autres signes de gravité clinique (troubles de la vigilance, fièvre très élevée…)
[33] Détaillés dans la fiche
[34] Gêne respiratoire rapportée par le patient, évaluée sur une échelle de 0 (je respire normalement) à 10 (j’ai une gêne maximale) ou par une échelle verbale
[35] « RECOMMANDATIONS PERSONNEL SOIGNANT
Faire appel à un autre soignant si possible. Si le soignant est seul (n’entre pas dans la chambre en l’absence de nécessité mais peut aller chercher les traitements et matériel nécessaire). Rester calme ou arriver calme (y penser avant d’entrer dans la chambre). Avertir le médecin si possible Expliquer simplement la situation au patient, ce que l’on fait, ce que l’on va faire. Injecter le protocole de sédation prévu etc.
« Après l’épisode, prendre un temps avec la famille et les soignants. » Toujours la langue de bois selon Orwell : n’est-ce pas de mort, de décès qu’il s’agit ? Non un épisode de la vie, pas de Plus belle la vie, c’est certain.
[36] Isabelle Luccioni L’Associu corsu di a salute refuse « un tri barbare et arbitraire » corse Matin 02 avril 2020
[38] « Les enfants sont tués par ingestions échelonnées et sur-dosées de barbituriques comme le phénobarbital ou le véronal, voire de morphine, mélangés à la nourriture des patients ou vaporisés au prétexte d’une protection contre le typhus. Ces overdoses conduisent à des paralysies respiratoires, et à l’arrêt du fonctionnement du système digestif et rénal. Il est ainsi toujours possible d’invoquer une cause apparemment naturelle de décès. Le procédé est développé début 1940 par Hermann Paul Nitsche, qui devient ensuite le directeur médical de l’Aktion T4. La sous-nutrition et le séjour en chambres très peu chauffées accroît les effets des ingestions médicamenteuses tout en préservant l’apparence d’un décès naturel et contingent.
Hermann Pfannmüller (de), directeur d’une clinique infantile à Munich, teste des « régimes alimentaires spéciaux » consistant à diminuer progressivement la quantité de nourriture administrée aux enfants, et à ne pas leur donner du tout d’élément gras dans les portions38. Les enfants meurent de dénutrition à plus ou moins longue échéance, sous couvert d’expérimentation de régimes alimentaires » IBID.37
[39] Ulf Schmidt, « Euthanasie » und die aktuelle Sterbehilfe-Debatte : Die historischen Hintergründe medizinischer Ethik, Gœttingue, 2000, « Kriegsausbruch und « Euthanasie » : Neue Forschungsergebnisse zum « Knauer Kind » im Jahre 1939
[40] Udo Benzenhöfer, Der Fall Leipzig (alias Fall „Kind Knauer “) und die Planung der NS-„Kindereuthanasie “, Münster, Klemm & Oelschläger, 2008, 151 p. (ISBN 978-3-932577-98-7), p. 51 IBID.37
[41] Peter Sandner, Verwaltung des Krankenmordes. Der Bezirksverband Nassau im Nationalsozialismus, Gießen, Psychosozial-Verlag, 2003, 788 p. 587 IBID.37
[42] Angelika Ebbinghaus et Klaus Dörner, Vernichten und Heilen. Der Nürnberger Ärzteprozeß und seine Folgen, Berlin, 2002 p. 297 IBID.37
[43] Michael Tregenza, Aktion T4, 2011 IBID.37
[44] Argument favori d’Attali dans sa guerre contre « les vieux » qu’il se garde bien d’appliquer à lui-même
[45] A. Laffont et J. Audit, « Eugénique », Encyclopédie médico-chirurgicale, Masson, 1934, p. 12-15
Fascicule 5122. IBID.37
[47] Bertold Brecht la résistible ascension d’Arturo Ui
[50] Contrairement à de très nombreux pays
[51] Avis 106 de 2009 sur « Les questions éthiques soulevées par une possible pandémie grippale
[52] Avis 128 de 2018 Enjeux éthiques du vieillissement
[53] Contribution du 13 mars 2020 sur « Enjeux éthiques face à une pandémie
[54] Avis du 30 mars 2020 Réponse à la saisine du ministère des solidarités et de la santé sur le renforcement des mesures de protection dans les EHPADs et les USLD