Cometriq*[1] cabozantinib et cancer médullaire de la thyroïde de l’adulte localement avancé ou métastatique symptomatique.
Un miracle chasse l’autre …
Comme Caprelsa* n’est pas le miracle espéré[2], pas d’inquiétude, une nouvelle merveille suit. Le Cometriq * (cabozantinib ) est un inhibiteur de tyrosine kinase multi cible visant les facteurs de croissances EGFR, VEGFR et l’oncogène RET, susceptible de ralentir la croissance des tumeurs et en particulier des rares carcinomes médullaires de la thyroïde[3].
« Autorisation accélérée » aux USA en 2012 : une seule étude Exam et en avant ! AMM ET REMBOURSEMENT A 100%
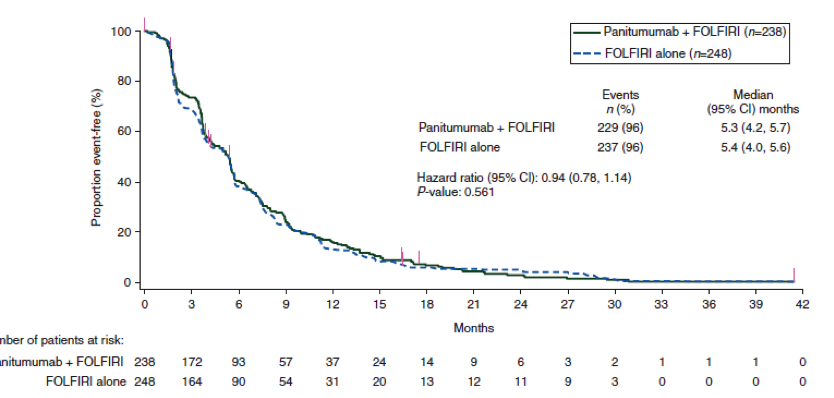
Il a bénéficié le 29/11/ 2012 d’un processus d’autorisation accélérée de mise sur le marché par la FDA[4] puis par l’EMA le 21/03/ 2014 sous le statut de « médicament pour maladie orpheline » sur la foi de l’étude pivot EXAM[5] affirmant (sur 330 malades avec un suivi médian de 14 mois) qu’il augmentait la durée médiane de stabilisation tumorale de 7.2 mois (11,2 mois avec contre 4 sans traitement).
Lors de la publication initiale de l’étude EXAM, les auteurs ne donnaient pas de résultats précis de survie globale, prétextant un recul trop court. Deux ans plus tard, ils confirmaient l’incapacité du cometriq* à augmenter[6] la durée de vie, en dehors des rares (environ 20%) malades porteurs de tumeurs avec mutation du gène RET pour lesquels ils espéraient encore. L’ AMM conditionnelle de l’EMA précise : « chez les patients pour lesquels la mutation réarrangée au cours d’une transfection (RET) n’est pas connue ou est négative, l’éventualité d’un bénéfice plus faible doit être prise en considération avant la décision d’un traitement individuel ». Efficacité plus faible !! Que va-t-il rester ?
Et 5 ans après l’autorisation de mise sur le marché aux USA, aucun bénéfice de survie globale n’a été rapporté par une essai randomisé.
Qu’importe, on continue !
Or dans le cadre d’une maladie d’évolution imprévisible (et souvent très lente dans ce cas précis),l’augmentation de la durée de survie globale est l’élément majeur pour affirmer l’utilité d’un médicament.
Le suivi des patients et des familles atteintes -chez plusieurs membres -de cette maladie héréditaire rare[7], confirme ce que dit la littérature internationale : l’évolution est lente et imprévisible et les malades suivis depuis plus de trente sans traitement actif ans sont légion. Des malades présentant des métastases pulmonaires sont suivis depuis plus de dix ans par notre équipe ou ses correspondants. [8]
Un danger spécifique à ce cancer de la thyroïde à prendre en compte.
En dehors des cancers dits sporadiques, ce cancer s’intègre souvent dans des syndromes associant plusieurs maladies neuroendocriniennes, comportant par exemple les phéochromocytomes, tumeurs surrénaliennes révélées éventuellement par des variabilités tensionnelles majeures mais souvent peu parlantes cliniquement pendant de longues années. Il s’insère également fréquemment dans le cadre d’un syndrome malformatif de type marfanoïde avec atteintes vasculaires (néoplasies endocriniennes multiples type 2B).
Ces précisions sont nécessaires pour soupeser le contexte dans lequel on propose le Cometriq *. Précisons que ce cancer n’est « sporadique », c’est-à-dire isolé que tant que les médecins n’ont pas découvert la pathologie associée comme le phéochromocytome qui peut se manifester bien des années plus tard. Donc vigilance car il est probable que la concomitance de pathologies associées rendrait encore plus risquée l’utilisation de cette molécule.
Car ce médicament est non seulement inefficace, mais il est aussi dangereux ! et probablement d’autant plus en cas d’affections associées.
COMPLICATIONS du Cometriq *
Il expose à de multiples complications[9] : diarrhée, syndrome mains pieds, qui implique une éruption cutanée et un engourdissement des paumes et de la plante des pieds), perte de poids, et d’appétit, nausées, fatigue, troubles du goût, changements de couleur des cheveux, hypertension, inflammation des muqueuses dont les stomatites (inflammation des muqueuses de la bouche), constipation, vomissements, faiblesse et modification du son de la voix.
Les anomalies sanguines couramment observées sont une élévation des enzymes hépatiques (SGPT, SGOT et phosphatases alcalines), un taux trop élevé de bilirubine témoignant d’une atteinte hépatique, trop faible nombre des globules blancs (lymphopénie ou neutropénie), ou des plaquettes (thrombocytopénie) traduisant la toxicité sur la moelle sanguine, et des troubles métaboliques :hypocalcémie , hypophosphatémie, hypomagnésémie, et/ou hypokaliémie.
Mais des complications plus graves encore émaillent parfois la vie des patients qui absorbent ce médicament : pneumonie, dysphagie (difficulté à avaler), déshydratation, embolie pulmonaire (caillots dans les vaisseaux sanguins irriguant les poumons) dangereuse et parfois mortelle, hypertension, abcès, des fistules gastro intestinales(3,3%) ou d’autres localisations (3,7%) et des hémorragies sévères (1%) pouvant aussi entraîner la mort. Une ostéolyse de la machoire a été signalée, imposant un suivi stomatologique rapproché. Enfin les habituelles possibilités de leucoencéphalite avec ce type de drogues sont également à craindre et déjà retrouvées.
Au total : 72% des malades doivent réduire les doses du traitement[10] et un malade sur 6 est contraint de l’arrêter pour intolérance. C’est une proportion très importante traduisant la trop courte étude avant commercialisation et/ ou la trop grande « tolérance » des agences pour accorder l’AMM certes transitoire mais si rarement remise en question !
L’évaluation de la qualité de vie par le module spécifique pour la thyroïde MDASI THY a montré une détérioration du score dans le groupe Cometriq par rapport au groupe placebo, à la 12ème semaine de traitement, du fait d’une augmentation de l’incidence et de la sévérité des symptômes notamment gastro-intestinaux.
Insuffisamment efficace sur la tumeur, incapable d’augmenter la survie des malades et dangereux, le Cometriq * se révèle donc inutile pour les malades.
Sa toxicité potentiellement mortelle fait pencher la balance avantage/risques nettement du côté des risques et le fait classer dans la liste des médicaments dangereux de la revue Prescrire 2017[11].
La responsabilité des agences
Il faut une fois de plus souligner la responsabilité des agences de régulation des médicaments (FDA et EMA) qui ont accordé une autorisation de mise sur le marché à un médicament, sans en connaitre ni les indications précises (pas de test compagnon Ret validé) ni la posologie optimale[12] !
AMM sans dose précise conseillée !
Ainsi que le constate l’EMA qui précise « le titulaire de l’autorisation de mise sur le marché s’est engagé à conduire avant le 31 mars 2019 une étude de comparaison des doses (XL-184-401) (140 mg vs 60 mg) chez 112 patients atteints d’un cancer médullaire de la thyroïde (CMT),héréditaire ou sporadique ».
Cette AMM donnée sur la seule affirmation d’une stabilisation transitoire de la progression tumorale, sans gain de survie globale, sans prise en compte de la toxicité a transformé ainsi, à leur insu, de nombreux malades en cobayes ! Cobayes dont certains risqueront de perdre la vie du fait du médicament, tandis que beaucoup souffriront de complications auxquelles ils n’auraient jamais dû être exposés. On peut vraiment parler d’AMM « pony express » pour l’équivalent d’une phase 1 (recherche de la dose adéquate).
De plus, ces agences n’ont toujours pas suspendu l’AMM alors que le processus d’autorisation accélérée dont a bénéficié le cabozantinib* aux USA et l’autorisation de mise sur le marché conditionnelle attribuée par l’EMA prévoit que les informations manquantes doivent être fournies par la firme pharmaceutique lors d’études complémentaires permettant d’évaluer le bénéfice réel et le risque de complications. A ce jour aucune des études prévues n’a été publié et l’AMM n’a pas été suspendue.
A ce jour, ce médicament n’est pas commercialisé en France dans cette indication, le dossier d’AMM étant probablement en attente à l’ANSM[13]. Il est néanmoins commercialisé sous le nom de Cabometyx * pour le cancer avancé du rein.[14]
POSOLOGIES RECOMMANDEES : dose recommandée de COMETRIQ est de 140 mg une fois par jour, prise sous la forme d’une gélule orange de 80 mg et de trois gélules grises de 20 mg. Traitement poursuivi aussi longtemps qu’il existe un bénéfice pour le patient ou jusqu’à la survenue d’une toxicité intolérable.
Compte-tenu de la toxicité du cabozantinib, une surveillance rapprochée des patients traités doit être mise en place au cours des huit premières semaines de traitement afin de pouvoir procéder si nécessaire, aux adaptations de la posologie. Une interruption temporaire de l’administration et/ou une réduction de la posologie peuvent être justifiées en fonction de l’évaluation individuelle de la tolérance.
—
[2] Cf article sur caprelsa* sur notre site
[3] Sans rapport avec l’habituel cancer papillaire de la thyroïde , le carcinome médullaire de la thyroide est une vraie maladie rare héréditaire et familiale d’évolution le plus souvent très lente sur des décennies, évolution extrêmement variable d’un patient à l’autre.
[4] US Food and Drug Administration. Approved Drugs: Cabozantinib; 2012.
[5] Rossella Elisei, Cabozantinib in Progressive Medullary Thyroid Cancer J Clin Oncol 31:3639-3646. © 2013
[6] Schlumberger M, Elisei R, Muller S, et al. Final overall survival analysis of EXAM, an international, double-blind, randomized, placebo-controlled phase Ill trial of cabozantinib (Cabo) in medullary thyroid carcinoma (MTC) patients with documented RECIST progression at baseline. Presented at: The 2015 Annual Meeting of the American Society of Clinical Oncology, Chicago, IL; 2015. Abstract 6012
[7] Tant en clinique que dans le groupe d’études des tumeurs à calcitonine créé en 1984
[8] Même le laboratoire Sanofi genzyme qui commercialise le Caprelsa précise à juste raison : « la décision d’utiliser CAPRELSA doit être soupesée avec soin en se fondant sur une évaluation des risques et des bienfaits chez les patients présentant une maladie indolente, asymptomatique ou d’évolution lente en raison des risques importants liés au traitement. CAPRELSA ne doit être prescrit que par un médecin qualifié agréé aux fins du Programme de distribution restreinte de CAPRELSA, et ayant de l’expérience dans l’administration des antinéoplasiques et le traitement du cancer médullaire de la thyroïde. Il est évident que ces précautions devraient s’appliquer également pour Cometriq* !
[9] Agence européenne du médicament Résumé EPAR à l’intention du public Cometriq cabozantinib
[10] Kurzrock R, Sherman SI, Ball DW, et al. Activity of XL184 (Cabozantinib), an oral tyrosine kinase inhibitor, in patients with medullary thyroid cancer. J Clin Oncol. 2011;29(19):2660–2666.
[11] Site www.prescrire.org
[12] Jadis, au siècle dernier, c’étaient les essais de phase I qui résolvaient ce problème, soit deux étapes avant la présentation pour l’AMM
[13] Agence française du médicament
[14] Voir chapitre adapté