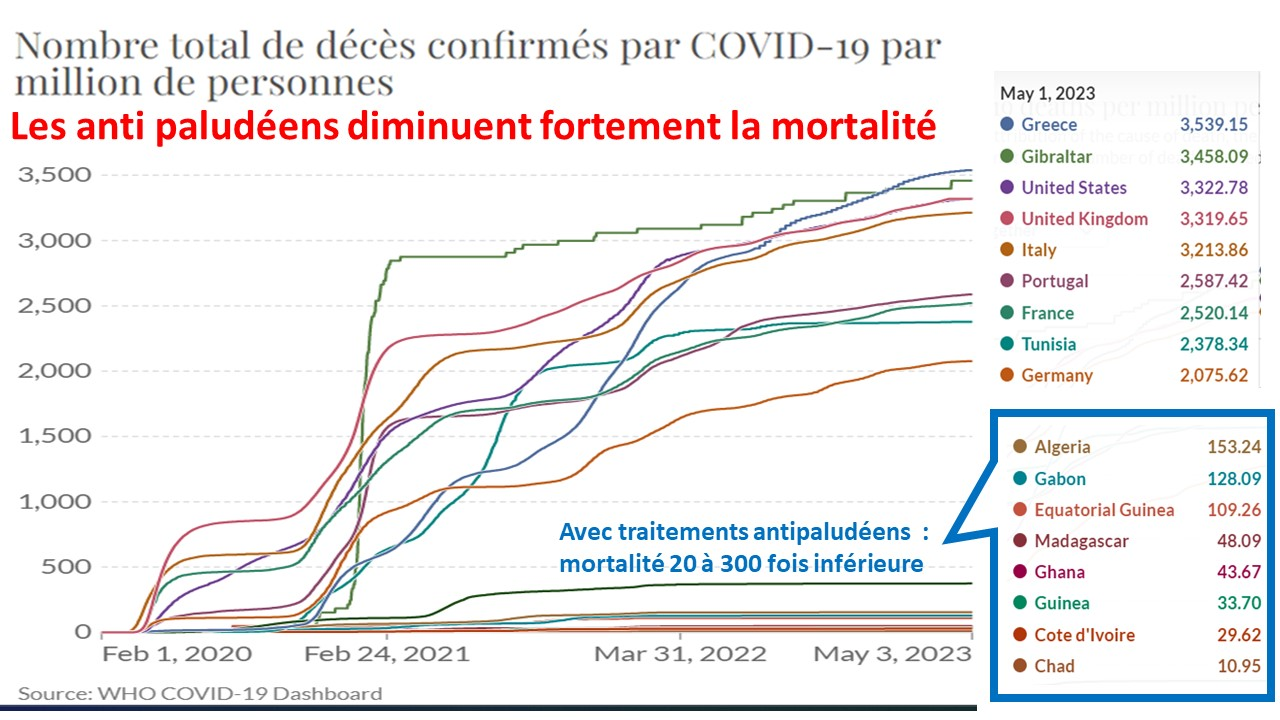
Depuis l’échec (prévisible[1]) de la contre-offensive ukrainienne, les populations occidentales sont l’objet d’une propagande intensive pour les préparer à une guerre qui n’a aucune raison de concerner la France malgré ce que l’Otan[2], l’UE et les médias veulent nous faire croire.
Petit rappel historique
L’histoire la Crimée est intimement liée à celle de la Russie. Saint Vladimir, évangélisateur de la Russie au christianisme oriental a été baptisé en 988 en Crimée (à Chersonèse). L’éphémère principauté rassemblant les territoires d’Ukraine se nomma d’ailleurs « Russ de Kiev »
La bataille de Kalka en mai 1223 annonce la conquête de la Russ de Kiev par Batu Khan, petit-fils de Gengis Kahn à partir de 1237. En cinq ans il fait raser la majorité des villes et massacrer la presque totalité de ses habitants scellant la disparition de l’Ukraine des principautés russes.
A partir de 1768, Catherine II libère l’Ukraine et la Crimée de l’empire ottoman et les réintègre à la Russie. En 1783 elle fait construire le port de Sébastopol. C’est en Crimée que l’empereur Alexandre II fit bâtir son palais de Livadia autour duquel l’aristocratie russe prit ses villégiatures, habitude reprise par les apparatchiks communistes après la chute des Romanov.
La période des communistes a été marquée pour l’Ukraine par la grande famine de 1932-1933 qui causa ainsi la mort d’au moins 4 millions d’habitants[3].
Durant la seconde guerre mondiale, des dirigeants nationalistes ukrainiens comme Bandera ou Stetsko se déclarèrent partisans des nazis en espérant d’obtenir l’indépendance, mais ils furent envoyés en camp de concentration de Sachsenhausen, jusqu’en 1944 ou ils furent libérés pour se battre avec les troupes nazis contre les soviétiques. Le nombre des légionnaires ukrainiens, souvent originaires de Galice, qui prirent part à la formation militaire aux côtés des Allemands (Wehrmacht, SS, police) s’élève à 250 000 [4] [5] dans des bataillons de la police de sûreté ukrainienne Schutzmannschaft, dite « Chouma », sous les numéros 109, 114, 115, 116, 117, et 118 et de la 14e division de grenadiers SS Galicie (première division ukrainienne). Ils s’illustrèrent entre autres par le massacre de polonais en Volhynie (50000 à 100000 victimes) et par celui de juifs de Kiev à Babi Yar en septembre 1941 (100000 à 150000 victimes) auquel participa activement le 201e bataillon Schutzmannschaft composé en grande partie d’Ukrainiens nationalistes.
Malgré leurs crimes nazis et leur antisémitisme indiscutables, Stepan Bandera et Roman Choukhevytch sont honorés pour leur combat pour l’indépendance de l’Ukraine face à l’Union soviétique. En 2010 Le président Viktor Ianoukovytch a signé un décret donnant à Stepan Bandera le statut de « Héros de l’Ukraine », des statues le représentant ont été érigées et des avenues portent son nom. Et à Marioupol des soldats ukrainiens du régiment Azov portaient leur symbole de l’époque nazie !
En 1954, Nikita Khrouchtchev détacha la Crimée de la Russie et l’offrit à sa province natale, la République socialiste d’Ukraine, ce qui dans le cadre de l’URSS, n’avait alors qu’une importance symbolique.
La dissolution de l’URSS en 1991 a inclus dans l’Ukraine les populations très majoritairement russophones de Crimée et des provinces de l’Est. Cela aurait pu rester une curiosité de l’Histoire sans importance si les dirigeants ukrainiens n’avaient pas entamé une politique de nettoyage linguistique et administratif en fermant les écoles qui enseignaient en russe et en chassant les responsables russophones, puis une véritable répression armée contre les populations qui ne voulaient pas se soumettre, aboutissant à la première guerre d’Ukraine.
En en août 2014, après une défaite militaire à Ilovaisk, l’Ukraine a signé l’accord de Minsk I. L’Ukraine s’engageait à amnistier les participants au conflit, à procéder à des élections locales et, dans la Constitution, à reconnaître à la région une autonomie de fait, avec en particulier autodétermination linguistique, droit pour les autorités locales des ORDLO, de nommer procureurs et juges, de constituer des « unités de police du peuple », d’avoir une « coopération transfrontière avec des districts de la Fédération de Russie », tout cela s’accompagnant d’un soutien social et économique de l’État ukrainien.
La Russie devait rapatrier son matériel et ses mercenaires, et reconnaitre les frontières du partage de l’URSS.
L’approbation des Accords de Minsk par la communauté internationale a trouvé son expression dans une résolution du Conseil de sécurité de l’ONU sur l’Ukraine. Mais aucun des engagements ne fut respecté à part ceux d’échanges de prisonniers[6]. Comme l’Ukraine refusait d’établir un calendrier clair de la réforme constitutionnelle, les discussions se sont éternisées, et la guerre a repris.
Et depuis son indépendance l’Ukraine s’est affirmée comme un des pays les moins démocratique et le pays le plus corrompu d’Europe légalisant même les rétributions financières du ventre de ses femmes pour la gestation d’étrangers. Prétendre qu’elle représente nos valeurs est donc très discutable.
La guerre Russie-Ukraine est un conflit qui ne nous menace pas.
Sauf si nous nous en mêlons imprudemment pour suivre l’OTAN et l’UE !
Dans ce conflit aucun de nos intérêts nationaux ou stratégiques n’est menacé.
Durant les deux guerres mondiales, la Russie a été toujours été une alliée précieuse dont de Gaulle avait compris l’intérêt stratégique qu’il avait souligné avec l’envoi de l’escadrille Normandie rebaptisée Normandie-Niemen,[7] alors que l’Ukraine avait choisi le camp nazi.
Lors du conflit Géorgie-Russie en 2008, la neutralité française lui avait permis de jouer le rôle d’intermédiaire de paix et de faciliter un armistice salvateur.
Au lieu de rester neutre et de faciliter la paix comme nous devrions le faire, nous encourageons les Ukrainiens à se faire massacrer pour une cause perdue d’avance. En dehors des médias propagandistes, qui peut en effet croire qu’un petit pays sans industrie lourde puisse vaincre un pays industrialisé, aguerri, à la population trois fois plus nombreuse et qui dispose de l’arme nucléaire ? Livrer des armes à l’Ukraine n’aboutit qu’à prolonger inutilement le conflit, de faire couler le sang, ruiner les pays de l’UE et mettre leurs populations en danger d’holocauste nucléaire.
Et c’est une guerre qui aurait pu être évitée, explique un député européen [8] : «
Brainless Partisans
@BPartisans
Mick Wallace, député européen : « C’est une guerre qui aurait pu être évitée. Une guerre qui aurait pu être stoppée le 22 avril. Mais nous ne voulions pas la paix, nous voulions la guerre. Nous voulions déclencher une guerre par procuration menée par les États-Unis et l’OTAN pour nuire à la Russie. »
Yuriy Lutsenko, ancien procureur général et ancien chef du ministère ukrainien de l’Intérieur, a récemment appelé le gouvernement à dire la vérité sur le nombre de victimes. Selon lui, l’Ukraine perd actuellement 30 000 soldats par mois <.Nous devons essayer d’arrêter ce massacre, si vous ne vous souciez pas de la classe ouvrière ukrainienne qui est simplement jetée dans un hachoir à viande. »
Les USA trouvent dans ce conflit le moyen d’affaiblir la Russie et l’Europe
La guerre en Ukraine a été voulue par l’administration Biden afin d’affaiblir la Russie et de faire entrer l’Ukraine dans l’Otan, alors que les accords post guerre froide prévoyaient la préservation d’un glacis neutre au contact immédiat de la Russie. De la même manière que J.F. Kennedy ne pouvait pas accepter des fusées soviétiques à Cuba, Vladimir Poutine ne peut admettre que l’Ukraine héberge des bases militaires américaines à sa frontière; il l’avait dit. La discrimination sanglante envers les russophones ukrainiens lui a fourni le prétexte d’intervenir militairement.
Si les Ukrainiens et les Russes paient le prix du sang, la guerre constitue pour les Américains, une excellente opération commerciale et politique, du moins à court terme. Grâce aux sanctions européennes le gaz de schiste américain a remplacé le gaz naturel russe malgré son coût beaucoup plus élevé qui handicape d’autant l’industrie européenne et le pouvoir d’achat des populations de l’UE. Il est devenu rentable ! Des dirigeants d’états européens jusque-là neutres regardent maintenant avec envie l’Otan. L’industrie des armements essentiellement américaine voit ses commandes culminer.
Le lobby militaire US prépare une guerre ouverte contre la Russie
En janvier 2023, l’OTAN a déployé des éléments de sa force de réaction interarmées qui compte 40 000 militaires avec comme fer de lance une brigade multinationale renforcée par des unités aériennes et maritimes et des forces spéciales que le secrétaire général de l’OTAN, Jens Stoltenberg a ainsi qualifié
« Cette réponse est un renforcement de la posture de dissuasion et de la défense des alliés » et le 28 septembre 2023 : « l’hypothèse d’une guerre longue en Ukraine est de plus en plus souvent évoquée par les dirigeants de l’alliance Atlantique qui étudient une éventuelle intégration de l’Ukraine au sein de l’Otan, une adhésion était «plus proche que jamais». Adhésion qui aurait l’intérêt pour les Américains de précipiter les européens dans une guerre contre la Russie comme alliés militaires de l’Ukraine sans demander l’avis des peuples !
Le 19 janvier 2024, à l’issue de la réunion des chefs d’état-major des pays membres de l’alliance et de la Suède le président du Comité militaire de l’OTAN, Rob Bauer a déclaré aux journalistes « les civils doivent se préparer à une guerre totale avec la Russie dans les 20 prochaines années et préparer une circonscription de masse »
Le 18 janvier 2024, au cours d’une conférence de presse à Bruxelles, le général américain Christopher Cavoli, président du Comité militaire de l’OTAN a précisé « Quelque 50 navires de guerre, 80 avions et 1 100 véhicules de combat prendront part à ce plus vaste « jeu de guerre » depuis l’exercice « Reforger » de 1988 ».
Ce qui n’est pas arrivé dans nos sociétés, c’est la compréhension que ce n’est pas seulement l’armée qui doit être capable d’opérer dans un conflit ou une guerre. C’est toute la société qui va s’impliquer, que cela nous plaise ou non. (…) Je ne dis pas que ça ira mal demain, mais nous devons comprendre que ce n’est pas une évidence que nous soyons en paix et c’est pour cela que nous avons des projets« « Un grand nombre de civils devront être mobilisés en cas de déclenchement d’une guerre et les gouvernements devraient mettre en place des systèmes pour gérer le processus. »
Toutes ces déclarations et gesticulations guerrières montrent que les Etats-Unis accélèrent la préparation économique, industrielle, politique et sociale à un conflit avec les « pays rivaux » (c’est-à-dire la Chine et la Russie), il faudra probablement encore plusieurs années aux États-Unis et aux pays européens pour développer leurs capacités de production militaro-industrielle aux niveaux nécessaires pour assumer un conflit avec la Russie ou la Chine, sans parler des deux en même temps. L’industrie militaire devra passer sous le contrôle direct de l’État pour adapter les usines doivent à la production militaire. La production de produits stratégiques pour l’économie devra être relocalisée au plan national. Nous sommes menacés d’une transformation sociale radicale marquée par une plus grande austérité au nom de la guerre. Un élément essentiel de ce processus est de soumettre politiquement et idéologiquement la population ».
L’hypothèse d’une guerre longue en Ukraine est de plus en plus souvent évoquée par les dirigeants de l’alliance Atlantique qui étudient une éventuelle intégration de l’Ukraine au sein de l’Otan. Jens Stoltenberg déclarait le 28 septembre dernier qu’une adhésion était «plus proche que jamais». Une telle adhésion rendrait de facto la France en guerre avec la Russie !
Les dirigeants allemands suivent les USA et poussent aussi à la guerre
Lors d’une interview du 16/12/23, le ministre allemand de la défense Boris Pistorius a exhorté les industries de défense européennes à « se préparer au possible déclenchement d’une nouvelle guerre d’ici la fin de la décennie »
Le quotidien allemand « Bild » a révélé un exercice de la Bundeswehr baptisé « Alliance défense 2025 » qui imagine un envenimement du conflit en Ukraine dans lequel l’Otan déciderait (en mai 2025 !) le transfert de 300.000 soldats aux frontières orientales dont 30.000 soldats de la Bundeswehr. Mais le peuple allemand se révolte contre Scholz depuis plusieurs semaines. Les dirigeants ne feront peut-être pas ce qu’ils veulent comme depuis des décennies ? [9]
L’UE ruine les populations pour plaire aux USA
Les sanctions imposées par la Commission Européenne ont abouti à la perte des dizaines de milliards que nous avions investis en Russie et des marchés qu’elle nous offrait. Elles nous obligent à acheter notre énergie à des prix exorbitants, responsables d’une inflation sans précédent récent, de la faillite de nombreuses petites et moyennes entreprises, d’innombrables suppressions d’emploi et d’un appauvrissement sévère de notre population. Sans compter que l’achat et le transport du gaz de schiste américain aggravent les pollutions que nous prétendons combattre.
Les sanctions de l’UE ne punissent que les Européens et affaiblissent gravement nos industries, tandis que l’économie russe est épargnée. En novembre 2023 Le PIB russe était en hausse de 5,5% malgré l’inflation et un rouble faible [10], tandis que l’économie allemande enregistrait une baisse du produit intérieur brut de 0,3 %.[11] Les paysans européens, déjà victimes de l’accumulation de normes écologiques et des taxes voient leur situation devenir désespérée sous l’effet de l’augmentation des taxes, des prix de l’énergie et de l’ouverture de nos frontières aux produits ukrainiens (blé, poulets…) sans droits de douane ni respect de nos critères sanitaires.
Les mesures antirusses de l’UE nous ruinent, nous rendent cobelligérants et nous mettent en danger de guerre nucléaire.
Macron joue au chef de guerre et menace ainsi la sécurité des Français
L’aide militaire de la France à l’Ukraine estimée à 3,2 milliards d’euros « trente canons Caesar, pièce maîtresse de l’artillerie française, des chars légers, quantité de missiles antichars, anti aériens, et même des missiles longue portée Scalp.… » alors que notre armée manque d’armes et de munitions.
Lors d’une conférence de presse conjointe avec son homologue ukrainien, le nouveau chef de la diplomatie française, Stéphane Séjourné, a affirmé « L’Ukraine est et restera la priorité de la France », « C’est en Ukraine que se joue la défense des principes fondamentaux du droit international, des valeurs de l’Europe, mais aussi des intérêts et de la sécurité des Français ». Mais comment peut-on être aussi aveugle ?
Lors de sa conférence de presse mardi 17 janvier 2024, le président Emmanuel Macron a promis que « nous continuerons à aider les Ukrainiens », notamment en les équipant « dans tous les domaines qui leur sont essentiels », et en particulier, « les frappes à distance ». Et malgré un budget contraint, nos impôts vont continuer à enrichir des Ukrainiens corrompus pendant que l’on refuse les baisses de taxes indispensables à la survie des paysans et pécheurs au bord de la faillite et du suicide[12].
Dans sa loi de programmation militaire n° 2023-703 du 1er août 2023 passée inaperçue, il expose sa démarche d’« économie de guerre » et sa politique guerrière assujettie à l’OTAN, et aux bons désirs du conseil des ministres ou du premier ministre:
Art. L. 2212-1.-En cas de menace, actuelle ou prévisible, pesant sur les activités essentielles à la vie de la Nation …ou de nature à justifier la mise en œuvre des engagements internationaux de l’Etat en matière de défense, la réquisition de toute personne, physique ou morale, et de tous les biens et les services nécessaires pour y parer peut-être décidée par décret en Conseil des ministres.
« Art. L. 2212-2… le Premier ministre peut ordonner, par décret, la réquisition de toute personne, physique ou morale, de tout bien ou de tout service…« Il peut également habiliter l’autorité administrative ou militaire qu’il désigne à procéder aux réquisitions.
« Art. L. 2212-9.-Est puni d’un emprisonnement de cinq ans et d’une amende de 500 000 euros le fait de ne pas déférer aux mesures légalement ordonnées en application des articles L. 2212-1 et L. 2212-2.
Livrer des armes dans ce conflit lointain sans intérêt réel pour notre nation nous rend cobelligérant et nous entraîne dans une spirale susceptible d’aboutir à une guerre de terrain, voire nucléaire.
Est-ce là vraiment l’intérêt de la France ?
Nous n’avons vraiment aucune raison valable pour prendre part à ce conflit.
Sortons du commandement militaire intégré de l’OTAN, comme l’avait fait De Gaulle le 21 février 1966 [13]avec des arguments toujours d’une brulante actualité : « Des conflits où l’Amérique s’engage dans d’autres parties du monde, …, risquent de prendre, en vertu de la fameuse escalade, une extension telle qu’il pourrait en sortir une conflagration générale. Dans ce cas, l’Europe, dont la stratégie est, dans l’O.T.A.N., celle de l’Amérique, serait automatiquement impliquée dans la lutte lors même qu’elle ne l’aurait pas voulu. » « Enfin, la volonté qu’a la France de disposer d’elle-même, volonté sans laquelle elle cesserait bientôt de croire en son propre rôle et de pouvoir être utile aux autres, est incompatible avec une organisation de défense où elle se trouve subordonnée. »
« Au total, il s’agit de rétablir une situation normale de souveraineté, dans laquelle ce qui est français, en fait de sol, de ciel, de mer et de forces, et tout élément étranger qui se trouverait en France, ne relèveront plus que des seules autorités françaises. »
Chirac avait été clairvoyant en refusant de participer à la seconde guerre d’Irak dans laquelle les USA et l’OTAN voulaient nous entraîner en mentant sur l’existence d’armes de destruction massives. Le bilan de cette guerre a été catastrophique : l’OTAN a renversé un tyran laïc pour mettre à sa place un gouvernement islamiste proche des Iraniens et aboutir à la création de l’état islamique.
Mais Chirac a suivi aveuglément l’OTAN en Afghanistan ce qui nous a couté inutilement la mort de 88 soldats français, et les blessures de 700 autres[14] pour qu’en définitive l’administration Biden abandonne le pays aux talibans.
Sortons du commandement militaire intégré de l’OTAN le plus vite possible !

Si l’UE et l’OTAN veulent la guerre, qu’ils la fassent sans la France, si les autres peuples l’acceptent ce qui est loin d’être probable, comme le démontrent les manifestations antiguerres qui se multiplient de l’Italie à la Pologne [15] [16] en passant par l’Allemagne elle-même[17]. Marcheurs et paysans défilent ensemble maintenant dans toutes les villes d’Allemagne, toujours dans le silence des médias.
Ici ce soir à Memmingen, ville de 43.000 habitants, malgré le froid. Une pancarte en premier veut dire « Dehors de l’OTAN et l’OMS ». Vous comprenez pourquoi les médias aux ordres n’en parlent pas.
Il est temps de laisser la place à la diplomatie comme le ministre de la Défense italien l’a rappelé le 10/1/24[18] « qu’il fallait considérer la situation militaire avec réalisme « De ce point de vue, il semblerait que le temps soit venu pour mettre en place une diplomatie incisive, parallèlement à un soutien militaire. » En France des voix s’élèvent outre celles dr F Asselineau, et floriant Philippot, le petit-fils du général de Gaulle souhaite que la France sorte de l’OTAN et entre dans les Brics.[19]
Nous voulons rester en paix. La guerre n’est tolérable que lorsque nos intérêts vitaux (le territoire national) sont menacés ce qui n’est pas le cas et ce qui a peu de risques d’arriver depuis que De Gaulle nous a permis d’accéder à l’arme nucléaire.
Refusons que nos enfants soient envoyés au front pour faire plaisir à nos alliés pour des conflits qui ne nous concernent pas.[20]
Alertons nos députés pour qu’ils refusent la dérive guerrière du président qui fait la guerre sans jamais les consulter.
« Soyons très clairs : La Russie et Poutine ne menacent pas plus la paix en Europe que la fausse pandémie de « Covid19 » n’a menacé la santé et la vie des gens en bonne santé.
C’est la violation de tous les accords internationaux par le gouvernement ukrainien, avec le soutien des gouvernements occidentaux, qui est à l’origine de l’opération spéciale et des centaines de milliers de morts parmi les jeunes Ukrainiens utilisés comme chair à canon par les Occidentaux et les politiciens au pouvoir à Kiev. Ce n’est ni Poutine ni la Russie.
Ceux qui menacent la paix en Europe, ce sont les gouvernements occidentaux actuels aux mains des milliardaires mondialonazis qui ne veulent surtout pas d’un hypothétique retour de Trump aux affaires »[21].
Quittons les coalitions qui veulent généraliser la guerre. Sortons du commandement militaire intégré de l’OTAN.
Sortons de l’UE qui nous pousse à la guerre : Frexit !
[1] https://nouveau-monde.ca/lunion-europeenne-cest-la-guerre-il-faut-en-sortir-via-le-frexit/
[2] L’OTAN, bras armé du mondialisme (reseauinternational.net) « Issue du traité du 4 avril 1949 instaurant le Conseil de l’Atlantique Nord (CAN) et réunissant les USA et les principaux pays de l’hémisphère nord tombés les uns après les autres au fil des siècles sous la férule de l’oligarchie anglo-saxonne, l’OTAN (Organisation du Traité de l’Atlantique Nord) est officiellement lors de sa création, une alliance défensive censée défendre le «monde libre» contre la menace communiste.
Ce n’est qu’en 1955 et en réaction à l’adhésion de la République fédérale allemande (RFA – ancienne Allemagne de l’ouest) à l’OTAN, que les Soviétiques réagiront en créant le Pacte de Varsovie et en y intégrant les États socialistes situés dans l’orbite de Moscou.
Le général de Gaulle prit l’initiative en 1966 de faire sortir la France du commandement intégré de l’OTAN, mesure qui fut abrogée par Nicolas Sarkozy en 2009 en réintégrant notre pays – sans la moindre consultation – dans cette alliance politico-militaire.
Présentée comme un instrument de défense destiné à protéger les populations de l’Occident contre une éventuelle offensive soviétique, l’OTAN, avec la participation active de la CIA et du MI6 britannique, a dès son origine, constitué dans la plupart des pays qu’elle contrôlait, des noyaux clandestins anti-communistes (appelés réseaux stay behind par les Anglo-Saxons) dont un des plus célèbres fut le Gladio italien qui fut responsable de plusieurs attentats sanglants durant les années 70 et 80 du siècle dernier ».
[3] L’affaire Lyssenko, une éclipse de la raison (erudit.org) résumé de l’article L’influence néfaste de Trofim Lyssenko (1898- 1976) domina la biologie dans l’empire soviétique durant le règne de Staline. Lyssenko assura son succès en promettant de sauver l’agriculture soviétique de la catastrophe où elle se trouvait à la suite de la politique désastreuse de collectivisation et d’une succession de mauvaises récoltes. Lyssenko affirmait avoir mis au point des méthodes permettant d’imposer des caractères héréditaires voulus à des plantes, et même de transformer à volonté une espèce en une autre. Il dénonçait la « génétique bourgeoise » comme une imposture et finit par étouffer tout débat scientifique et toute opposition en faisant arrêter ou exécuter nombre de scientifiques éminents. Les théories absurdes de Lyssenko contaminèrent les milieux scientifiques en Europe de l’ouest et furent saluées par beaucoup d’intellectuels communistes, notamment en France. Le phénomène Lyssenko est un exemple extrême de la perversion de la science par l’idéologie, souvent avec l’assentiment de la communauté scientifique. Est-il aussi certain que ce type d’événement ne puisse arriver aujourd’hui ? <
[4] (Александров К. М., Обреченные на подвиг (K. M. Alexandrov « Condamnés à l’exploit »)
[5] Гареев М. А. О цифрах старых и новых // Военно-историчесикй журнал 1991. no 4. С. 49 (M.A. Gareïev : des chiffres, les anciens et les nouveaux // Journal de guerre)
[6] Après Angela Merkel, l’aveu de François Hollande : Les accords de Minsk, duperie de l’Occident ? – Strategika « L’ancien président français s’est aligné sur Angela Merkel qui, le 7 décembre dans un entretien à Die Zeit, affirmait que les accords de Minsk avaient été « une tentative de donner du temps à l’Ukraine » pour se renforcer militairement en vue d’une confrontation future avec Moscou.
Officiellement, ces accords signés le 5 septembre 2014 avaient été conclus avec l’objectif affiché de rétablir la paix entre Kiev et les Républiques du Donbass. Leur conflit a fait près de 15 000 morts (civils et militaires) entre 2014 et 2022.
À la question de savoir si les négociations de Minsk était destinées à retarder les avancées russes en Ukraine, François Hollande a répondu par l’affirmative : « oui, Angela Merkel a raison sur ce point. Les accords de Minsk arrêtèrent l’offensive russe pour un temps. Ce qui était important était de savoir comment l’Occident utiliserait ce répit pour prévenir toute tentative russe ultérieure ».
Hollande revendique avoir permis le renforcement de l’armée ukrainienne(….)
[7] 12 novembre 1942 – « Normandie-Niémen » sur le front de l’Est – Herodote.net : « À son arrivée à Londres, fin 1941, il livre au capitaine Mirlesse, du 2e bureau des Forces aériennes françaises libres (FAFL), son analyse du front de l’Est, avec une guerre d’usure qui ne peut que tourner à l’avantage des Soviétiques. Les deux hommes convainquent le général de Gaulle d’envoyer une force combattante française en URSS. Pour le fondateur de la France libre, l’enjeu d’une telle démarche ne se limite pas au plan militaire. Il y entre aussi d’incontestables considérations politiques. Par cette présence française, fût-elle symbolique, de Gaulle souhaite, aux yeux des Soviétiques qui l’ont reconnu comme chef de tous les Français libres, combler le vide laissé par le départ de la représentation de Vichy. En outre, en visionnaire qui n’entrevoit pas d’autre victoire finale que celle des Alliés, il entend ainsi se positionner en vue des discussions de l’après-guerre(…..) ».
[8] https://x.com/BPartisans/status/1747711502407135238?s=20
[9] https://x.com/BPartisans/status/1748787550162956300?s=20
[10] https://www.lefigaro.fr/flash-eco/le-pib-russe-en-hausse-de-5-5-malgre-l-inflation-et-un-rouble-faible-20231115
[11]https://www.lesechos.fr/monde/europe/trois-ans-apres-le-covid-leconomie-allemande-recule-a-nouveau-2046375
[12] Nouveau Monde — Allemagne : pourquoi Scholtz n’a pas d’argent pour ses agriculteurs (nouveau-monde.ca)
[13] https://www.youtube.com/watch?v=PoPAbyybGq4
[14] https://www.slate.fr/lien/67073/visages-noms-soldats-88-francais-morts-afghanistan
[15] https://x.com/SinedWarrior/status/1749727545392546140?s=20 l’adhésion de l’Ukraine à l’OTAN, c’est la «base de la Troisième Guerre mondiale»: la Slovaquie défie Washington «Je mettrai mon veto», a martelé le Premier ministre Robert Fico. Bratislava bloquera l’adhésion de Kiev à l’OTAN dirigée par les Etats-Unis
[16] https://x.com/FilFrance/status/1749729908790607895?s=20
[17] https://x.com/silvano_trotta/status/1748065527644246522?s=20
[18] Le ministre italien de la Défense estime que l’heure est à la diplomatie Par Reuters le 10.01.2024
[19] « Je veux reconstruire la France de mon grand-père ! »- Pierre de Gaulle (youtube.com)
[20] D’autres le clament également : Mourir pour l’OTAN ? Sans moi, merci… – Profession Gendarme (profession-gendarme.com)
[21] Ibid 15