Quand les résultats de simulations mathématiques remplacent les résultats réels dans l’information médicale diffusée par les médias.
Par les docteurs Nicole et Gérard Delépine
Qu’est-ce que la médecine de simulation en 2018 ?
La médecine de simulation imagine, à l’aide de modèle mathématiques et des statistiques, le futur vraisemblable qui est censé attendre chacun d’entre nous. La recherche fondamentale s’est tournée vers la simulation avec gourmandise, oubliant que cette dernière est un péché ! Par exemple, elle simule les effets biologiques d’une multitude de molécules et de combinaisons biologiques, avant l’essai. Ou encore, elle déduit de la présence d’une mutation présente chez un individu l’espérance de vie sur les quarante prochaines années[1]
« La simulation informatique ou numérique désigne l’exécution d’un programme informatique sur un ordinateur ou réseau en vue de simuler un phénomène physique réel et complexe (par exemple : chute d’un corps sur un support mou, résistance d’une plateforme pétrolière à la houle, fatigue d’un matériau sous sollicitation vibratoire, usure d’un roulement à billes…). Les simulations numériques scientifiques reposent sur la mise en œuvre de modèles théoriques utilisant souvent la technique des éléments finis. Elles sont donc une adaptation aux moyens numériques de la modélisation mathématique, et servent à étudier le fonctionnement et les propriétés d’un système modélisé ainsi qu’à en prédire son évolution. Les interfaces graphiques permettent la visualisation des résultats des calculs par des images de synthèse. ».[2]
« A travers toutes ces avancées, la simulation représente une nouvelle manière d’interagir avec le monde et, du coup, en transforme la perception. Des êtres d’un nouveau type sont créés, que ce soient des mannequins robotisés, des images virtuelles, des programmes de raisonnement clinique, des prédictions du futur, qui agissent sur notre conception de la maladie, de la souffrance et du temps. Le danger est bien sûr que la simulation crée un monde concurrent au réel et que le monde simulé finisse par s’imposer comme une norme. Les humains sont d’une immense variété mais, de plus en plus – et la simulation participe à ce phénomène – il leur est demandé de se conformer aux standards issus d’algorithmes et de scénarisations de données. Soit leur souffrance correspond à ce monde, soit elle n’existe pas. Heureusement, parce que ce sont des humains, ils ne cessent de tricher (de simuler) pour utiliser le système et ses normes tout en leur résistant.
« L’imaginaire était l’alibi du réel, dans un monde dominé par le principe de réalité, écrit Baudrillard.3 Aujourd’hui, c’est le réel qui est devenu l’alibi du modèle, dans un univers régi par le principe de simulation »[3].
Nous nous sommes demandés pourquoi tant d’articles qui nous paraissent « mensongers » étaient autant rediffusés par les médias et de nombreux collègues ayant réellement « foi » en la science. Même si la marchandisation et la corruption peuvent expliquer en partie ce phénomène, tous ne sont pas corrompus, mais tous sont crédules. Le sujet est complexe. De fait, notre société obnubilée par l’argent l’est aussi par la nouveauté et par la science, et surtout par l’informatique et les miracles qu’apporteraient le numérique ! La plus grande révolution depuis l’imprimerie, dit mon frère… La grande différence entre les articles de vulgarisation médiatique et les articles source est aussi en partie linguistique. Combien de fois les conditionnels des articles scientifiques originaux ne se transforment -ils pas en présent affirmatif dans leur reprise de vulgarisation !
Nous nous sommes collectivement jetés dans les applications du numérique, pensant qu’il allait résoudre tous nos problèmes. De l’apprentissage de la lecture en donnant beaucoup trop tôt à des petits enfants des tablettes, à l’intelligence artificielle en médecine qui supprimerait le besoin de médecins humains. Si on peut aller dans la Lune, l’ordinateur doit pouvoir nous surpasser en médecine. Et non. Et quarante ans après ces rêves fous, on commence à découvrir les dégâts… A commencer par nos enfants pour qui le maniement de la tablette leur fait perdre l’usage de leurs dix doigts et la stimulation de zones cérébrales capitales à leur développement moteur et intellectuel
Ainsi ces articles du Monde du Figaro ou de la télé, s’ils sont « mensongers » de fait par rapport à la réalité concrète chez les malades, ne sont pas totalement mensongers dans l’absolu, car racontent des « réalités virtuelles » informatiques crédibles : de l’efficacité présumée d’un vaccin dans dix ou quinze ans, calculées par des statisticiens avec leurs outils informatiques. Mais l’ordinateur ne peut rendre que ce que lui a donné l’homme. Et le public prend pour réalité les données virtuelles, comme les adolescents intériorisent le personnage de leurs jeux vidéo ou de leur feuilleton. Le mensonge vient de la manipulation via la présentation des données comme fait établi et non virtuel.
Des calculs statistiques honnêtes, mais souvent trompeurs dans la vraie vie, aux manipulations marchandes
LA MARCHANDISATION de la médecine utilise les données virtuelles qui lui sont favorables en les présentant au grand public comme réalité bien concrète, sans insister sur le caractère purement VIRTUEL de cette « réalité ». La boule de cristal fondée sur les ordinateurs n’est pas toujours plus juste que les prévisions des cartomanciennes qui foisonnent sur internet. Les voyantes ont d’ailleurs la cote[4], jusqu’au Parlement français, sans que cela ne semble poser de problème éthique, ni même théorique. De plus en plus de mages ou d’avaleurs de feu entrent dans les maisons de santé (vides de médecins) sans guère susciter d’indignation, en dehors de notre profession.
Le XXIème siècle sera mystique ou ne sera pas avait dit Malraux, il est devenu effectivement scientiste, si ce n’est religieux, la médecine étant facilement intériorisée comme une religion à dérives sectaires.
Dans le secteur public tout comme dans le secteur privé, on constate de plus en plus une fascination à l’égard des prédictions[5] censément scientifiques (marché agricole et coaching des agriculteurs, enseignement, par exemple).
La médecine n’y échappe pas. Complexée depuis longtemps de n’être qu’un « art fondamentalement humain, aidé par la science » et non une science dure[6], elle tente sa revanche en devenant de plus en plus « scientifique », en tous cas l’espère-t-elle. Elle est même tombée dedans comme Astérix dans la potion magique. N’oublions pas l’amertume de tant d’étudiants qui faisaient médecine car incapables d’intégrer les grandes écoles et même les classes préparatoires. Est-ce encore vrai ? Et le mépris des médecins par les énarques, ou les X Mines des ministères a perduré… Au lieu de résister à cette dérive jalouse (qui tient la vie humaine entre ses mains ?), les décideurs médicaux universitaires et politiques ont dévié la médecine de son objet réel, l’homme, multipliant les formations « scientifiques » pour les docteurs qui ne seraient nommés professeurs qu’après l’accumulation de diplômes universitaires de plus en plus éloignés du malade.
Ainsi déjà dans les années 80, on comprenait qu’il valait mieux publier sur la membrane cellulaire de la drosophile que sur un traitement pilote de patients, pour être « reconnu ». Aggravation exponentielle en 40 ans où seul le gène compte, et où même les patients ne parlent que de mutation sur leur cancer, quand ils vous demandent un conseil (sans donner d’informations cliniques, amaigrissement, douleurs etc..).
Confusion entre réalité virtuelle et réelle
« Ces modèles ne sont pas pour autant vécus comme une fiction, comme le montre le comportement des équipes. Même en cas d’erreur grave, les formateurs, qui décident en temps réel du scénario de la simulation, ne font pas mourir les patients-mannequins. Les études ont en effet montré qu’une mort même fictive affecte réellement les élèves soignants. Là se trouve peut-être la meilleure preuve de la réussite de la simulation : le leurre agit jusqu’à l’intime des psychismes. »
Ces constatations assez tragiques expliquent probablement l’impact des émissions télévisées sur le citoyen lambda. Triste que le personnage de telle série soit assassiné…
La médecine tombée dans la science dure : une erreur majeure
La revanche de la médecine basée sur les prédictions scientifiques était à bout de doigt, on a plongé. Malheureusement, le caractère spécifique de l’humain par rapport aux autres « objets » virtuels entraine de nombreux échecs : inefficacité des drogues nouvelles, thérapies ciblées, immunothérapie, échec des programmes ambitieux de vaccination, inefficacité des programmes de dépistage précoce des cancers etc. La médecine est d’abord individuelle et la confier aux purs scientifiques ne marche pas.[7]
La vraie médecine est ingrate. Il faut examiner les malades, les écouter, repérer les signes utiles au diagnostic, les confirmer, puis prescrire le traitement le plus efficace.[8] Et même quand le diagnostic est exact et le traitement optimal, le résultat est parfois décevant. De plus, toute décision expose éventuellement à un procès ou à des remontrances de l’ordre des médecins, de votre directeur d’établissement ou de l’agence régionale de santé. Plus la prescription sera entourée de l’aura scientifique, plus le docteur robotisé se sentira en sécurité administrative et juridique. Malheureusement, l’expérience in vivo depuis les années 90 de management fondé sur les prédictions de réactions des patients et des soignants est un échec profond qui a fait passer le rang mondial de la médecine française du 1 er aux alentours du trentième et trop de médecins de l’enthousiasme pour la médecine du nouveau monde au suicide…
« Mais la médecine est un monde à part. Si les équipes soignantes peuvent parfois ressembler à des pilotes, l’homme malade n’est pas comparable à un avion. En raison d’abord de ses complexités enchevêtrées, mais aussi parce qu’il interagit avec les caractéristiques humaines des humains-soignants. Entre soignant et soigné – surtout lorsque ce dernier est conscient – circule de l’émotion, de l’angoisse, de la compassion, entre autres »[9].
Il est certes plus confortable de se réfugier dans les « prophéties médicales » d’autant qu’elles sont généralement très gratifiantes, positives dans un monde brutal et déprimé. Croire que la dengue ne sera plus un problème, ni la rougeole (seulement grave dans les pays sous-développés) donnent le moral, comme faire de la médecine dite humanitaire est un concept très apprécié des jeunes soignants. Comme si toute médecine n’était pas « humanitaire ». La détresse n’est pas présente qu’à l’autre bout du monde.
De l’utilisation de la médecine prédictive sincère à son détournement par les marchands.
Ces simulations de l’évolution des maladies, mais aussi des comportements des patients devenus consommateurs sont très prisées de la médecine devenue un commerce selon les volontés des dirigeants mondiaux à travers les accords du TISA par exemple.
Les équipes de recherche statistiques ont été choyées par big pharma et les fonds de pension pour aider (malgré elles au moins au début) au développement de la marchandisation à outrance de la médecine.
Généreusement subventionnées, elles participent à la propagande de la médecine marchande et bénéficient à ce titre du budget de publicité colossal des entreprises du médicament[10].
Analyse prédictive en médecine et son utilisation marchande
L’analyse prédictive est un processus qui tente d’approfondir les connaissances tirées des données acquises, pour en anticiper la signification et permettre de formuler des prédictions quant à l’avenir. L’innovation technologique et les bouleversements de la médecine ont joué un rôle important dans l’émergence de l’analyse prédictive en tant qu’outil pouvant être utilisé par les gouvernements et certaines entreprises pour orienter leur politique de santé.
Deux domaines offrent aux prophéties en médecine des perspectives très lucratives : la prédiction de l’excellence potentielle des résultats d’un traitement controversé[11], ou d’un vaccin, et la démonstration de son rapport cout/efficacité favorable.
La prédiction de résultats favorables d’un traitement controversé permet de justifier son indication, sa recommandation, voire son éventuelle obligation.
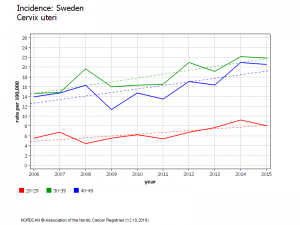
Exemple de l’utilité présumée du vaccin contre le cancer du col de l’utérus selon prévisions virtuelles (scénarii) versus réalité de la vraie vie (registres nationaux des cancers).
Elle est illustrée par de très nombreuses simulations de l’impact des vaccins anti-HPV et leur utilisation publicitaire. Pour donner une aura scientifique à leurs prédictions, les auteurs des articles des médias traitent les hypothèses (crédo) par ordinateur à l’aide de logiciels de simulation, (comme toutes les cartomanciennes, voyantes à la mode sur internet) et présentent leurs conclusions en « scénarios ».
Les articles publiés dans les médias se concentrent sur les simulations et s’affranchissent ainsi des faits constatés pour tenter de faire croire à un bénéfice de la vaccination. Or, comme le savent tous les informaticiens, l’ordinateur ne peut pas transformer des hypothèses fausses en vérité selon l’adage « Shit in, shit out ».
Il faut confronter les résultats des simulations à la réalité concrète. Ces confrontations devraient intéresser les vrais scientifiques et non ceux qui utilisent leurs résultats, manipulant de fait l’information transmise à la population.
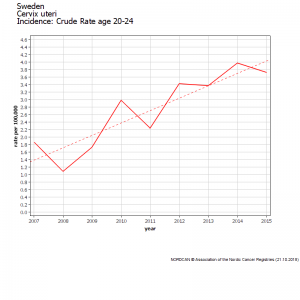
Deux articles récemment publiés en septembre et octobre 2018 et repris pas le Figaro et le Quotidien du médecin, promettent ENCORE « l’éradication » du cancer de l’utérus, grâce au Gardasil en Australie [12] et en Grande Bretagne. Et ce, malgré les faits avérés sur l’augmentation inattendue, mais réelle de ces cancers sous l’effet des vaccins anti HPV depuis mai 2018 par Lars Anderson sur les registres suédois et confirmés depuis lors par les travaux de Delépine, Garland etc. sur l’analyse des registres des cancers de différents pays dans lesquels le taux de vaccination est très élevée.
Ces deux articles sont de pures fictions qui ne présentent pas des faits avérés, mais des simulations basées sur des hypothèses fausses qui constituent, depuis toujours, le crédo des avocats de ce vaccin. Ces contes publicitaires sont ensuite diffusés par tous les médias[13] comme des faits avérés, pour mieux convaincre les familles de faire vacciner leurs enfants par le Gardasil.
Simulation/ faits avérés ; personnage virtuel d’une fiction/ personnage réel, tout se confond et la pratique +/- démesurée des réseaux sociaux par la génération née avec une souris dans la main (souris déjà obsolète…) facilite la confusion des genres dans la tête des jeunes médecins et des utilisateurs, patients devenus clients.
Première simulation de l’efficacité supposée du Gardasil en 2003
La toute première estimation de l’impact du vaccin anti HPV sur le cancer du col de l’utérus que nous avons retrouvé, date de 2003 et prédit [14] « un vaccin qui empêche 98% des HPV persistants 16/18 serait associé à une réduction approximativement équivalente du cancer associé au 16/18 et à une réduction de 51% du cancer total du col de l’utérus ».
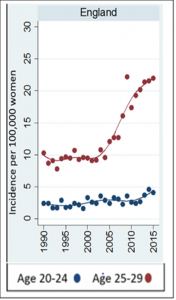
La dernière prédiction anglaise[15] de 2018 est plus précise et terriblement dangereuse par son impact médiatique international, non confronté aux résultats avérés par les registres internationaux : « la vaccination contre les types de VPH 16 et 18 diminuera de 55% l’incidence[16] du cancer du col utérin chez les femmes âgées de 25 à 29 ans et l’introduction de La vaccination à neuf valences à partir de 2019 de 36% supplémentaires (de 9,5 à 6,1 pour 100 000 femmes) d’ici 2036-2040. Les femmes nées avant 1991 ne bénéficieront pas directement de la vaccination ».
Certains prophètes australiens prévoient grâce à la vaccination [17] « une baisse de l’incidence de la maladie à 6/100000 en 2020 et de 42 à 51% en 2035 et une chute importante de la mortalité », tandis que d’autres encore plus radicaux, se gargarisant par avance d’éradiquer la maladie et en précisent même la chronologie[18].
Quels doux rêves ! Mais peut-on y croire ? A moins que ce ne soit de véritables et conscientes manipulations.
La « Kolossale » erreur des estimations anglaises de l’impact du vaccin
Pour juger de la fiabilité d’un devin, il est toujours utile de relire ses prédictions antérieures et de les comparer aux faits avérés depuis leur publication.
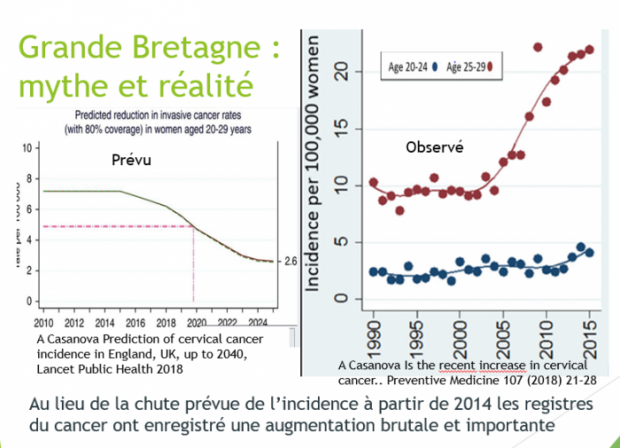
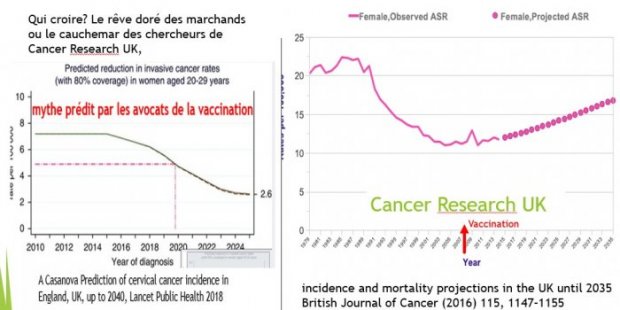
Relisons celles publiées en 2010[19] par l’un des auteurs de la dernière prophétie anglaise. « Pour le cancer invasif chez les femmes âgées de 20 à 29 ans, nous prévoyons une réduction de 63% de ces taux d’ici 2025 avec une couverture vaccinale de 80% ». Dans cette simulation, les auteurs situaient le début de la décroissance à 2015.
La couverture vaccinale a rapidement dépassé les 85% dans les groupes d’âge ciblés. Suivant leur simulation, les promoteurs de la vaccination s’attendaient que les taux de cancer du col diminuent à partir de 2014 chez les femmes âgées de 20 à 24 ans à mesure que les cohortes des adolescentes vaccinées entraient dans leur deuxième décennie.
a couverture vaccinale a rapidement dépassé les 85% dans les groupes d’âge ciblés. Suivant leur simulation, les promoteurs de la vaccination s’attendaient que les taux de cancer du col diminuent à partir de 2014 chez les femmes âgées de 20 à 24 ans à mesure que les cohortes des adolescentes vaccinées entraient dans leur deuxième décennie.
Malheureusement, les statistiques officielles[20] démentent totalement les chiffres de la simulation en montrant que les femmes de 20 à 25 ans ont vu leur risque de cancer augmenter rapidement à partir de 2012, l’augmentation atteignant 70% en 2 ans [21].
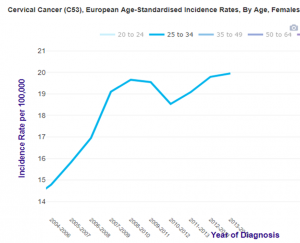
Les femmes de 25 à 29 ans ont subi une augmentation brutale et encore plus importante du taux de cancer du col utérin [22] aboutissant à un doublement de l’incidence du cancer du col (de 11 en 2006 à 22 en 2015), soit une incidence trois fois plus élevée que ne le prévoyait la simulation de 2010
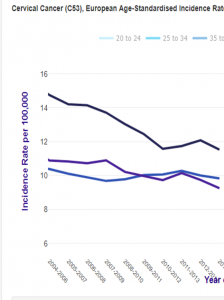
Les femmes de 25 à 34 ans, (moins vaccinées, car seulement exposées aux vaccinations « de rattrapage »), ont vu leur risque augmenter de 18% (de 17 en 2007 à 20 en 2014).
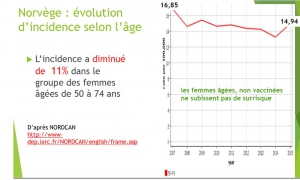
Et contrairement aux prévisions, les femmes plus âgées, non vaccinées ont vu leur risque diminuer (-13% pour les femmes âgées de 65 à 79 ans et -10% pour celles de plus de 80 ans), très probablement en raison de la poursuite du dépistage par frottis de dépistage du col utérin.
Crédibilité des simulations dans l’exemple du vaccin anti HPV :
Peut-on encore accorder crédit à des simulations qui se trompent autant, moins de six ans après leur conception ? Peut-on baser une politique de santé publique sur de pareilles légendes ?
L’office anglais des statistiques ne partage d’ailleurs pas l’optimisme forcené des prophètes de l’article puisqu’il estime [23] que « l’incidence du cancer du col devrait augmenter de 43% dans les deux prochaines décennies pour atteindre 17 pour 100000 en 2035. »
Le mythe australien de l’éradication du cancer, grâce à la vaccination.
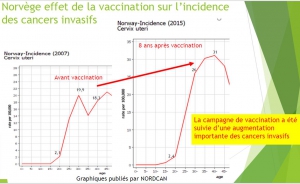
En 2007, l’Australie fut le premier pays à organiser la vaccination systématique pour les filles. Là aussi le promoteur de la vaccination (que les australiens considèrent comme une gloire nationale, à l’égal de Pasteur en France, car Ian Frazer, un des inventeurs du vaccin est Australien) promettait une réduction drastique de l’incidence du cancer du col.
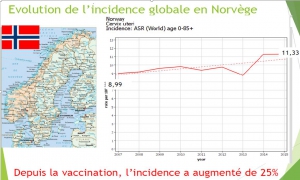
Mais, depuis la vaccination, ce n’est plus une diminution que les statistiques officielles révèlent, mais une augmentation, tant du nombre annuel de nouveaux cancers : (692 en 2006 contre 863 en 2014 et une estimation de 930 cas en 2018), que de l’incidence : 6.8 en 2006 vs 7.4 en 2014.
En Australie, depuis la vaccination, l’incidence standardisée monde du cancer du col utérin a augmenté de 10%.
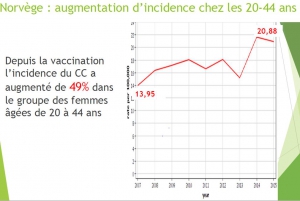
De plus, la hausse d’incidence touche spécifiquement les femmes vaccinées et parallèlement au taux de couverture vaccinale du groupe d’âge auquel elles appartiennent. Celles qui ont été vaccinées lorsqu’elles avaient entre 8 et 12 ans ont vu leur risque augmenter de 100% [24] . Celles qui avaient entre 13 et 17 ans lors de la vaccination : 113% d’augmentation.[25] L’augmentation d’environ 33% pour les femmes plus âgées moins vaccinées[26].
Durant la même période, les femmes plus âgées (et donc non vaccinées) ont vu leur risque de cancer diminuer [27] Et en Australie, contrairement aux prophéties inlassablement répétées, depuis la vaccination la mortalité[28] due à ce cancer a augmenté passant de1.7/100000 en 2014 à 2/100000 en 2017.
Plutôt que de se féliciter des résultats de leurs simulations, les apôtres australiens de la vaccination devraient regarder leurs statistiques du cancer et les comparer à ceux de notre pays. En France, où la couverture vaccinale est inférieure à 20%, l’incidence standardisée monde[29] a diminué de près de 20%, de 7.8 en 2006 à de 6.5 en 2011 et est estimée à 6 en 2017, chiffre que les australiens espèrent atteindre en 2020 !
Comment expliquer une telle discordance entre les simulations et la réalité ?
Les résultats d’une simulation dépendent directement des hypothèses retenues. Les principales hypothèses des simulations marchandes peuvent se résumer ainsi : le cancer invasif ne peut pas se produire en l’absence d’infection par un type de HPV oncogène. Le vaccin est efficace à vie et fait disparaître l’infection. Le vaccin va donc éradiquer le cancer. Mais toutes ces hypothèses sont discutables et les résultats de ces simulations ne font en fait que reproduire en chiffres la foi de leurs auteurs. La médecine n’est pas une science exacte, et la médecine via l’informatique oublie les spécificités complexes de la vie, singulièrement chez l’être humain.
Quelques exemples d’éléments non pris en compte par les statisticiens modélisateurs dans l’exemple vaccin anti HPV
L’étiologie des cancers du col ne se résume pas uniquement à la présence des HPV 16 et 18, elle est multifactorielle[30] [31] [32] [33]. Il existe plus de 150 HPV à tropisme humain dont près d’une vingtaine sont réputés carcinogènes. Il n’a jamais été possible de reproduire chez l’animal un cancer avec un virus HPV. Parmi les autres facteurs de risques connus de cancer du col utérin [34] [35] [36] figurent : l’âge précoce des premiers rapports sexuels[37], le nombre élevé de partenaires, les infections génitales à l’herpès et à Chlamydia trachomatis[38] [39] [40], le tabagisme [41] [42] [43] [44], un affaiblissement du système immunitaire, qu’il soit dû au Sida ou aux traitements immunosuppresseurs, le statut hormonal[45] et marital, la durée de contraception orale[46], la prise de Diéthylstilbestrol (DES)[47], le nombre de grossesses. [48] [49] [50]. La plupart de ces facteurs de risque connus sont statistiquement liés entre eux et avec les HPV, et les analyses multifactorielles réalisées pour attribuer à chaque facteur son importance propre portent sur trop peu de malades pour affirmer avec certitude un lien de causalité directe. L’infection aux HPV pourrait ainsi n’être qu’un marqueur d’activité sexuelle qui prédispose au cancer du col. Cette possibilité est lourde de conséquences : si les virus HPV ne sont pas responsables directs du cancer mais témoin, la vaccination n’a aucune chance de prévenir le cancer.
On ne connait pas la durée de protection anti infectieuse que procure le vaccin au-delà de dix ans. Admettre une persistance de la protection anti HPV la vie durant relève donc là aussi de la foi.
Surtout rien ne permet d’affirmer que l’éradication de quelques souches de HPV puisse faire diminuer le risque de cancer. Et les résultats avérés dont on dispose actuellement démontrent plutôt le contraire.
Ainsi en Australie, chez les femmes âgées de 18 à 24 ans, le taux d’infection par les HPV 16 et 18 a diminué de 95% [51], tandis que leur incidence de cancer du col augmentait de 113%[52] [53].
En Grande Bretagne, dans le même groupe d’âge, le taux d’infection par les HPV 16 et 18 a diminué de 50 %[54] tandis que leur incidence de cancer du col augmentait d’autant. [55]
Des chercheurs consciencieux se seraient précipités pour éclaircir ce paradoxe suivant le conseil de Niels Bohr[56] « C’est merveilleux que nous ayons rencontré un paradoxe. Maintenant nous avons de l’espoir de faire des progrès ». Peut-être certains l’ont-ils fait, mais sont passés sous silence …
Crédulité ou corruption ?
Par leur conception, les simulations de résultats médicaux sont toujours à risques de biais. Il faut tout particulièrement se méfier de leurs conclusions lorsqu’elles font la promotion d’un médicament rentable, que leurs auteurs sont liés aux firmes ou que l’ensemble des médias du monde entier claironne ensemble « la bonne nouvelle »[57] , alors qu’il ne s’agit en aucun cas de faits établis, mais seulement d’espoirs résultant d’hypothèses incertaines. Toujours bien vérifier quand vous lisez un article de presse !
Dans l’article australien de 2018, l’auteur principal est Ian H Frazer (titulaire du brevet sur le vaccin qui assure sa renommée et sa fortune), et la majorité de ses 7 coauteurs (qui ont tous été payés pour cette « étude ») sont très liés aux firmes qui commercialisent le vaccin ou les tests diagnostiques du HPV, qu’ils prônent également. Avant de croire à leur propagande marchande, Il est indispensable de confronter leurs rêves à la réalité des faits avérés.
Les auteurs des simulations anglaises ne bénéficient pas des mêmes retombées financières que I Frazer mais on peut remarquer qu’ils vivent tous principalement des programmes de vaccination et que leur étude a été réalisée à la demande de Jo ‘s cervical cancer trust qui bénéficie de l’aide financière de l’industrie du vaccin.

Quand on a en tête le manque de transparence, les manipulations scientifiques et les abus de pouvoir de l’État américain pour commercialiser ce vaccin, décrits dans le livre de Mary Holland, Kim Mack Rosenberg et Eileen « The HPV Vaccine on Trial : Seeking Justice for a Generation Betrayed »[58], on se doit d’être circonspect.
La médecine n’est pas une science, c’est un art humaniste qui nait de la rencontre physique entre un médecin et son patient en utilisant les acquis scientifiques du moment et du passé, clairement établis. A l’ère de la médecine 3.0, il peut paraître ringard d’examiner un malade ou d’analyser des résultats avérés, mais c’est le plus souvent ce type d’analyse qui permet de véritables progrès. Ne soyons pas dupes des devins !
« [59]Revenons à l’ambiguïté du début. Les patients aussi simulent. C’est même une de leurs grandes caractéristiques. D’où l’interrogation : sont-ils en cela imitables ? Des robots ou des programmes sont-ils capables de simuler leur simulation ? Non. Là se trouve leur limite. Les machines ne savent pas simuler. Elles ne parviennent à reproduire ni la compassion, ni le tragique, ni l’irréversible. Ni surtout les multiples artifices que les humains ont inventés pour jouer avec tout cela, pour le nier ou le magnifier, pour le transformer en mythe et en sens. Sur ce plan, les humains restent d’une totale singularité. »
[1] Tests sanguins de dépistage du cancer, leurre de la médecine personnalisée, sources de profits et de surmédicalisation. docteur.nicoledelepine.fr/tests-sanguins-de-depistage-du-cancer-leurre-de-la-medecine-personnalisee-voie-de-recherche-mais-pas-de-soin-en-2018
[4] Leurs sites sont les plus rentables pour les webmasters !
[5] Cette fascination pour son oracle a fait en son temps la fortune de la ville de Delphes
[6] Comme les mathématiques, la physique ou la chimie
[7] Cette dérive est marquée depuis une quarantaine d’années par les nombreux colloques, programme de recherche et autres réalisés et organisés par les grandes écoles type centrale, les mines etc. On est frappé par l’absence de « vrais médecins » (de soin comme dirait le Sénat) dans ces grand-messes. Malheureusement nos énarques et technocrates se basent sur ces études « scientifiques » pour leur plan santé et échouent régulièrement au grand drame des patients et des médecins de plus en plus suicidaires.
[8] Pour remettre les idées en place, lire le livre du Professeur HUMBERT « avez-vous un bon médecin ? » qui rappelle les bases de la clinique qui avait fait la réputation de la médecine française.
[9] Ibid1
[10] Soit environ 75 milliards de dollars annuels des 200 à 250 milliards consacrés au « développement »
[11] Florence Méréo Cancer : quand l’intelligence artificielle prédit l’efficacité d’un traitement Le Parisien Société Santé 27 août 2018
[12] M T Hall, Kate T Simms, Jie-Bin Lew, M A Smith, J ML Brotherton M Saville,et al. The projected timeframe until cervical cancer elimination in Australia : a modelling study the lancet public Health on line October 02, 2018
https://www.thelancet.com/journals/lanpub/article/PIIS2468-2667(18)30183-X/fulltext
[13] la prophétie australienne claironnant l’éradication du cancer par le Gardasil a été reproduite par le Figaro, L’obs, la dépêche du midi, Ouest France, Le quotidien du médecin, le réseau Régional d’Oncologie d’Ile de France, Univadis, Courrier international, France info, France 3, BFM, RTL et Michel Cymes, Europe 1,LCI santé, M6 météo, CNN, Top Santé, Santé Magazine, Madmoizelle, Pourquoi docteur, maxi science Gent side, Daily Geek Show, Science post, France diplomatie, le courrier du Vienam, French China Org,, Seronet, Nouvelles du Monde, Trust my science, Aider son Prochain, L’important, Medisquare, Sud Horizon, Chine Org !
[14] Goldie SJ, Grima D, Kohli M, Wright TC, Weinstein M, Franco E. A comprehensive natural history model of HPV infection and cervical cancer to estimate the clinical impact of a prophylactic HPV-16/18 vaccine. Int J Cancer. 2003 Oct 10 ;106(6):896-904.
[15] Alejandra Castanon, Rebecca Landy, Francesca Pesola, Peter Windridge, Peter Sasieni Prediction of cervical cancer incidence in England, UK, up to 2040, under four scenarios : a modelling study Lancet Public Health 2018 ;
3 : e34–43
[16] Incidence brute (Incidence observée) taux annuel de nouveau cas pour 100000 femmes
[17] M T. Hall, K T. Simms, Jie-Bin Lew, M A. Smith, M Saville, K Canfell. Projected future impact of HPV vaccination and primary HPV screening on cervical cancer rates from 2017±2035 : Example from Australia PLoS ONE 13(2) : e0185332.
[18] M T Hall, Kate T Simms, Jie-Bin Lew, M A Smith, J ML Brotherton M Saville,et al. The projected timeframe until cervical cancer elimination in Australia : a modelling study the lancet public Health on line October 02, 2018 https://www.thelancet.com/journals/lanpub/article/PIIS2468-2667(18)30183-X/fulltext
[19] J Cuzick, A Castañón and P Sasieni Predicted impact of vaccination against human papillomavirus 16/18 on cancer incidence and cervical abnormalities in women aged 20–29 in the UK Br J Cancer. 2010 Mar 2 ; 102(5) : 933–939.
[20] http://www.cancerresearchuk.org/health-professional/cancer-statistics/statistics-by-cancer-type/cervical-cancer/incidence#heading-Two
[21] de 2,7 en 2012 à 4,6 en 2014 p= 0,0006).
[22] Alejandra Castanona,⁎, Peter Sasienia, Is the recent increase in cervical cancer in women aged 20–24 years in
England a cause for concern ? Preventive Medicine 107 (2018) 21–28
[23] « Incidence rates for cervical cancer are projected to rise by 43% in the UK between 2014 and 2035, to 17 cases per 100,000 females by 2035 » Cancer research UK Cervical cancer statistics //www.cancerresearchuk.org/health-professional/cancer-statistics/statistics-by-cancer-type/cervical-cancer
[24] de 0.1 en 2007 à 0.2 en 2014.
[25] (de 0.7 à 1.5 dans le groupe des 20 à 24 ans vaccinées pour plus de 80% d’entre elles).
[26] car seulement exposées aux vaccinations « de rattrapage : de 5.9 à 8 pour le groupe 25-29ans et de 9.9 à 13.2 pour celles de 30-34
[27] : -17% pour les femmes de 55 à 59 ans (de 9.7 à 8.1), -13% pour celles de 60 à 64ans (de 10.3 à 8.9), -23% pour celles de75 à 79 ans (de11.5 à 8.8) et même -31% pour celles de 80 à 84 ans (de 14.5 à 10).
[28] Mortalité brute (mortalité observée) : nombre annuel de morts pour 100000 personnes
[29] Incidence standardisée : Incidence observée ramenée à une population type. Lorsqu’on veut comparer différentes périodes pour un même pays, la population standard d’une année de ce pays peut être la référence. Cependant si l’on veut faire des comparaisons d’un pays à l’autre il faut utiliser les incidences standardisées monde (ASR en anglais) qui ramène l’incidence à une population standard monde, afin de ne pas introduire de biais dû à la composition démographique de chaque pays.
[30] Hoover RN, Black A, Troisi R. Hormones and cancer. Thun MJ (ed.). (2018). Schottenfeld and Fraumeni Cancer Epidemiology and Prevention. (4th Edition). New York, NY : Oxford University Press. 22:395-410.
[31] Herrero R and Murillo R. Cervical cancer. Thun MJ (ed.). (2018). Schottenfeld and Fraumeni Cancer Epidemiology and Prevention. (4th Edition). New York, NY : Oxford University Press. 48 : 925-945.
[32] Franceschi S, El-Serag HB, Forman D, Newton R, Plummer M. Infectious agents. Thun MJ (ed.). (2018).
[33] Schottenfeld and Fraumeni Cancer Epidemiology and Prevention. (4th Edition). New York, NY : Oxford University Press. 24 : 433-460.
[34] Wegene Borena1Pre-vaccine era cervical human papillomavirus infection among screening population of women in west Austria Borena et al. BMC Public Health (2016) 16:889
[35] J. Eluf-Neto Human papillomavirus and invasive cervical cancer in Brazil . Br J. Cancer (I 994), 69, 114 119
[36] Louise A.Brinton, Joseph F.Fraumeni Jr Epidemiology of uterine cervical cancer journal of Chronic Diseases Volume 39, Issue 12, 1986, Pages 1051-1065
[37] A Berrington de Gonzalez*Comparison of risk factors for squamous cell and adenocarcinomas of the cervix : a meta-analysis British Journal of Cancer (2004) 90, 1787 – 1791
[38] Koskela P Chlamydia trachomatis infection as a risk factor for invasive cervical cancer. Int J Cancer. 2000 Jan 1 ;85(1):35-9.
[39] Paavonen J Chlamydia trachomatis and cancer Sexually Transmitted Infections 2001 ;77:154-156.
[40]Tarja Anttila Serotypes of Chlamydia trachomatis and Risk for Development of Cervical Squamous Cell Carcinoma JAMA, January 3, 2001—Vol 285, No. 1 47
[41] Roura E Smoking as a major risk factor for cervical cancer and pre-cancer : results from the EPIC cohort.Int J Cancer. 2014 Jul 15 ;135(2):453-66. doi : 10.1002/ijc.28666. Epub 2014 Jan 6.
[42] Passive smoking and cervical cancer risk : a meta-analysis based on 3,230 cases and 2,982 controls.
[43] Kjellberg L,.Smoking, diet, pregnancy and oral contraceptive use as risk factors for cervical intra-epithelial neoplasia in relation to human papillomavirus infection. Br J Cancer. 2000 Apr ;82(7):1332-8.
[44] International Collaboration of Epidemiological Studies of Cervical Cancer*Carcinoma of the cervix and tobacco smoking : reanalysis of individual data on 13,541 women with carcinoma of the cervix and
23,017 women without carcinoma of the cervix from 23 epidemiological studies Int. J. Cancer : 118, 1481–1495 (2006)
[45] Roura The Influence of Hormonal Factors on the Risk of Developing Cervical Cancer and Pre-Cancer : Results from the EPIC Cohort. PLoS One. 2016 Jan 25 ;11(1):e0147029. doi : 10.1371/journal.pone.0147029. 2016.
[46] La Vecchia C, Boccia S Oral contraceptives, human papillomavirus and cervical cancer. Eur J Cancer Prev. 2014 Mar ; 23(2):110-2.
[47] Société Canadienne du cancer facteurs de risques du cancer du col de l’utérus Read more : http://www.cancer.ca/en/cancer-information/cancer-type/cervical/risks/?region=on#ixzz5TuZCuGMP
[48] Brinton LA Parity as a risk factor for cervical cancer. Am J Epidemiol. 1989 Sep ;130(3):486-96.
[49]. Muñoz NRole of parity and human papillomavirus in cervical cancer : the IARC multicentric case-control study. Lancet. 2002 Mar 30 ;359(9312):1093-101
[50] N Muñoz Role of parity and human papillomavirus in cervical cancer : the IARC multicentric case-control study
The lancet 359, 9312, 1093-1101, 2002
[51] de 22.7% en 2005 à 1.1% en 2015
[52] de 0.7 à 1.5
[53] Australian Institute of Health and Welfare (AIHW) 2017 Australian Cancer Incidence and Mortality (ACIM) books : cervical cancer Canberra : AIHW. <Http ://www.aihw.gov.au/acim-books> ; ;.
[54] Clare Tantona,⁎, David Mesherb, Simon Beddowsc Human papillomavirus (HPV) in young women in Britain : Populationbased evidence of the effectiveness of the bivalent immunisation programme and burden of quadrivalent and 9-valent vaccine types Papillomavirus Research 3 (2017) 36–4
[55] (de 3.1 en 2007 à 4,6 en 2014)
[56]Physicien danois théoricien de la structure de l’atome et des réactions chimiques connu pour son apport à l’édification de la mécanique quantique. Lauréat du prix Nobel de physique de 1922
[57] En telles occurrences on peut supposer qu’un service de com efficace et riche s’agite pour diffuser le message promotionnel.
[58] « Le procès des vaccins HPV. Justice pour une génération trahie » Mary Holland, Kim Mack Rosenberg et Eileen Iorio Skyhorse paperback éditeurs
[59] Ibid 1