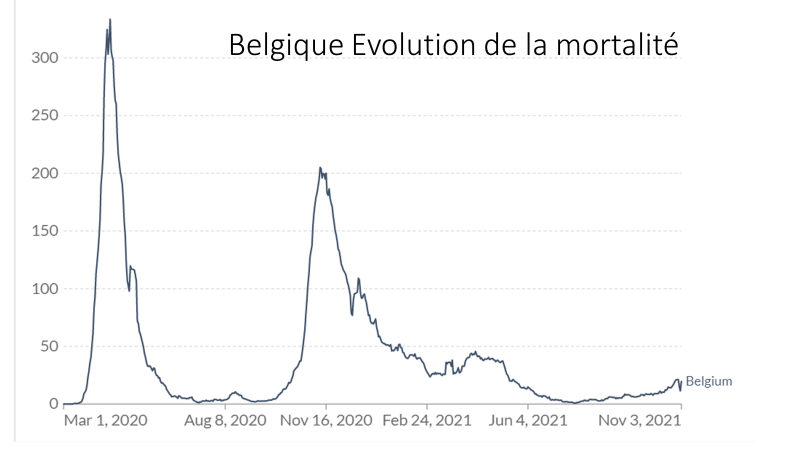
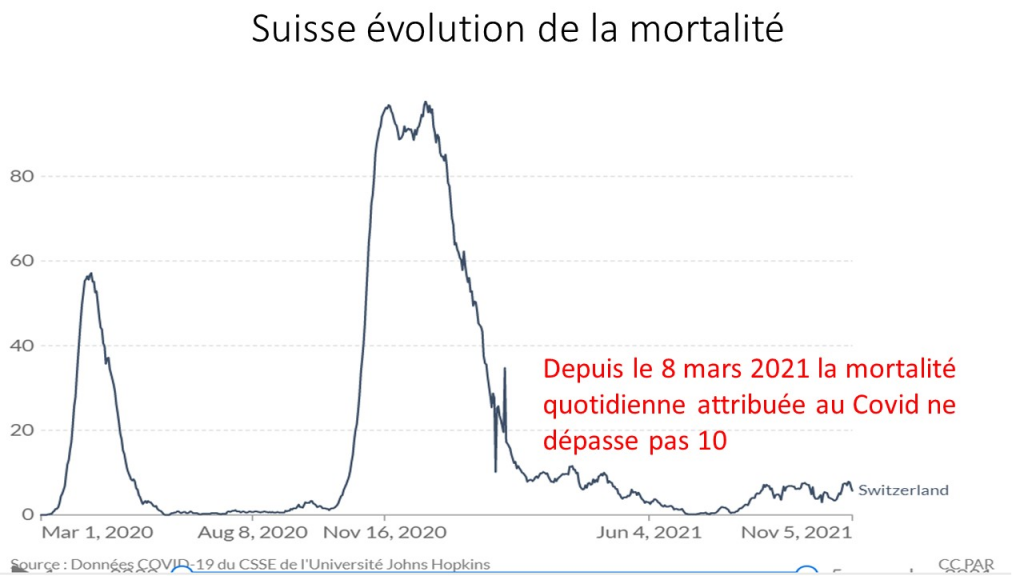
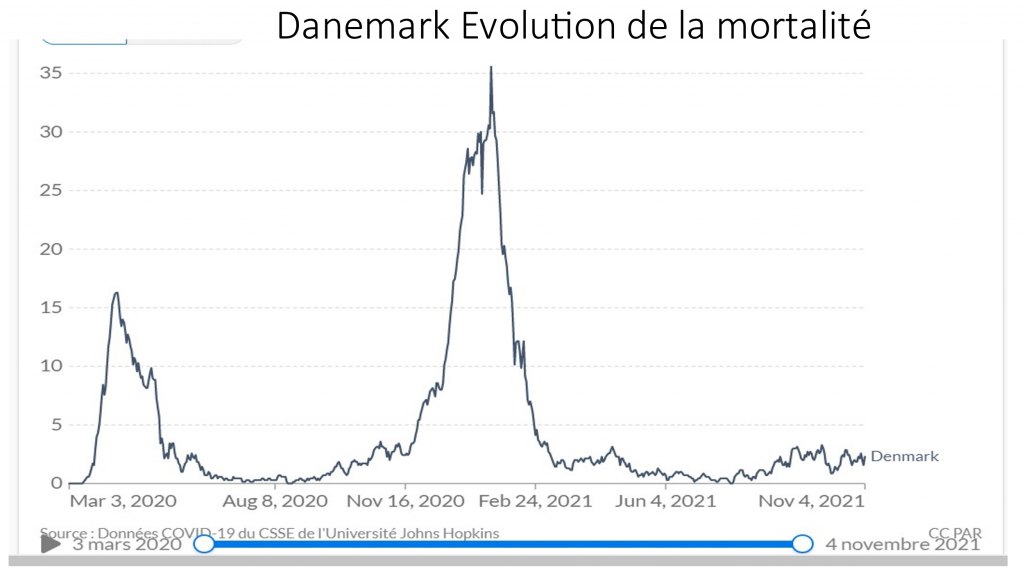
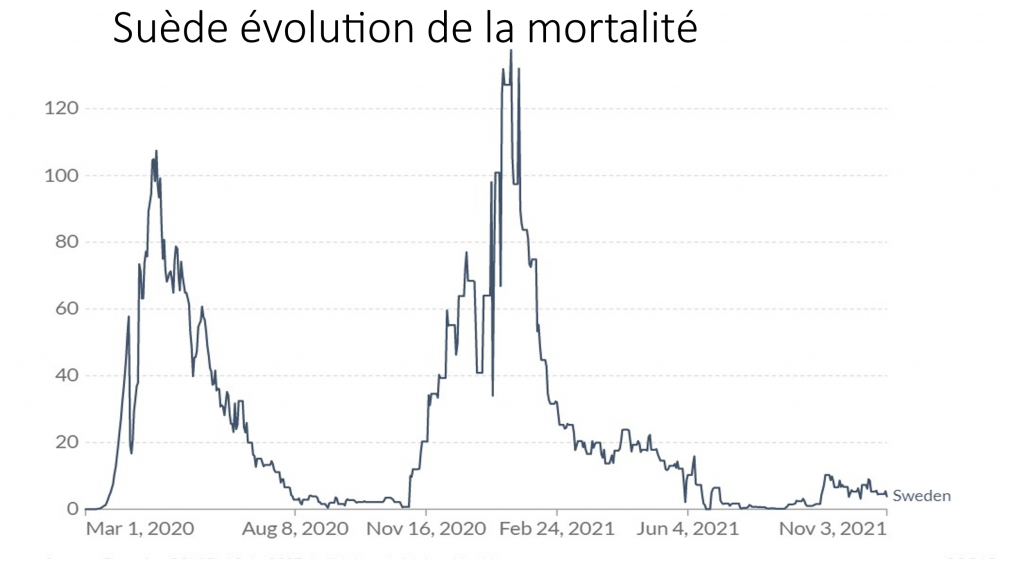
Les simulations, alibi pseudo scientifique truqué de la vaccination des enfants
Volet 2 de l’analyse des simulations-prédictions au cours de la crise covid :
Le scandale de la fermeture des écoles et des dommages infligés aux enfants
Depuis plus de 18 mois, la politique sanitaire française ne s’appuie pas sur les faits constatés dans le monde réel, mais uniquement sur des simulations mathématiques très majoritairement fausses, et faussées, pour justifier les décisions autoritaires de l’exécutif, nous faire accepter la perte de nos libertés et nous imposer les pseudo vaccins.
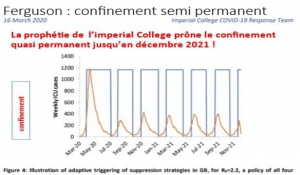
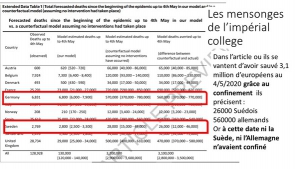
Dans un article précédent, nous avons démontré les erreurs (ou trucages ?) invraisemblables du rapport 9 de Ferguson (Imperial college ) de mars 2020 qui a servi de prétexte aux confinements, et des articles fallacieux écrits ultérieurement pour les justifier.[1]
Dans ce second volet nous rappellerons les données de la littérature internationale qui montrent que l’enfant ne participe pas à la transmission du covid19 et que toutes les mesures qui lui nuisent sont inutiles sur la maladie.
Les enfants sont innocents du Covid et ne transmettent pas la maladie
La fermeture des écoles imposée par la majorité des gouvernements, occidentaux en particulier de la planète, repose seulement sur la foi et/ou à l’obéissance en des simulations dont le modèle a été élaboré pour la grippe (où les enfants représentent effectivement un vecteur important de transmission).
Mais pour le covid 19, la littérature internationale montre que l’enfant est complètement innocent de la transmission.
Toutes les études épidémiologiques réalisées au début de l’épidémie prouvent qu’il est rarement atteint, que lorsque cela arrive c’est à domicile par l’intermédiaire d’un parent proche, qu’il fait des formes bénignes [2] [3] et qu’il ne transmet pas la maladie[4] [5] [6] [7] [8] [9] [10] [11] [12] [13] [14] [15] [16] [17], sauf exceptionnellement à ses parents, à domicile.
Le professeur Robert Cohen, pédiatre très pro vaccin précise : « les enfants ne sont pas des super-contaminateurs, bien au contraire, ils sont de tout petits contaminateurs ».
Il n’y a donc aucune raison scientifique de conseiller la vaccination des enfants dans l’espoir de protéger la population plus âgée, d’autant plus que les vaccins actuels n’empêchent pas les transmissions, que l’immunité obtenue après une guérison naturelle est beaucoup plus efficace et durable que celle post injection et que plus aucun scientifique indépendant de l’industrie des vaccins ou des gouvernants qui tentent de l’imposer ne croit encore que l’immunité collective puisse être obtenue par la vaccination.
Les écoles ne jouent aucun rôle prouvé dans la transmission du covid
Dans sa note du 20 avril 2020, le conseil scientifique reconnaissait : « Il n’y a pas eu d’épidémie documentée dans les crèches, écoles, collèges, lycées ou universités à ce jour, en l’état des connaissances actuelles, sauf une dans un lycée en France où le virus a touché 38% des lycéens, 43% des enseignants, et 59% des personnels travaillant dans l’établissement scolaire (Crépy-en-Valois). »
Or la transmission de l’épidémie de Crépy en Valois a été analysée par l’institut Pasteur[18] sans qu’aucune contamination par les enfants n’ait pu être mise en évidence « no secondary cases in the following 14 days among pupils, teachers and non-teaching staff of the same schools ».
Au 17 septembre 2021, malgré 226 844 344 cas confirmés par l’OMS, aucune étude épidémiologique n’a mis en évidence de transmission par des élèves à l’école et partout où les écoles sont restées ouvertes les autorités sanitaires ont constaté qu’il n’y a pas eu de transmission des écoles vers les communautés [19] [20] [21] [22].
De plus si les adultes qui travaillent dans les écoles peuvent être atteints et transmettre la maladie (via d’autres adultes), ils sont moins souvent atteints que les autres professions : « les enseignants ont montré un risque plus faible d’hospitalisation avec covid-19 et de covid-19 sévère) que la population générale [23]. Travailler en milieu scolaire a plutôt un effet protecteur contre le risque covid19.
Les données de surveillance nationale au Royaume-Uni ont montré que le personnel scolaire est moins exposé au risque d’infection en milieu scolaire que la population adulte en général[24].
Une autre étude, portant sur 57.000 personnes s’occupant d’enfants dans des crèches aux États-Unis, a également montré qu’il n’y avait pas de risque accru d’infection pour les personnes s’occupant d’enfants.
La fermeture des écoles et les mesures prétendument sanitaires qui ont été imposées aux enfants n’ont donc jamais eu aucune justification scientifique dans le monde réel.
Le statisticien Ola Rosling a déclaré au podcast « More or Less » de la BBC en juillet 2020 : « Nous avons gardé nos écoles ouvertes et je pense vraiment que tous les pays du monde peuvent le faire ».
Le 27 mai 2020, le premier ministre norvégien Erna Solberg à la télévision, a regretté le coût excessif du confinement pour son pays et s’est demandé si elle n’aurait pas mieux fait de suivre l’exemple de la Suède : « il n’était peut-être pas nécessaire de fermer les écoles ». « J’ai probablement pris de nombreuses décisions par peur« , a-t-elle ajouté.
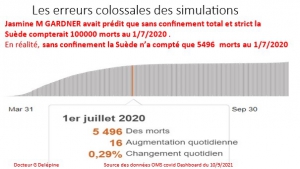
En juillet 2020, l’Agence suédoise de la santé publique et l’Institut finlandais de la santé et du bien-être ont publié une étude conjointe avec, révélant un taux similaire de cas de coronavirus chez les enfants en Suède, qui a maintenu les écoles ouvertes (et n’a pas imposé de masque), et en Finlande, qui les a fermées.
Les écoliers suédois peuvent remercier chaleureusement A. Tegnell et son équipe pour les décisions qui ont sauvé leur année scolaire 2020 et leur équilibre psychologique. Cet épidémiologiste a revu les prédictions de Ferguson, ne les a pas confirmées et son gouvernement l’a suivi à juste raison.
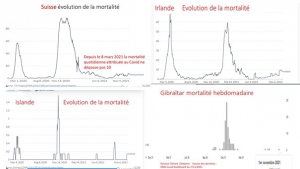
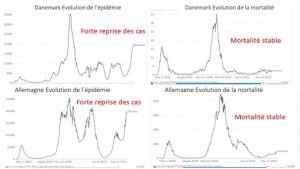
La réouverture des écoles n’a nulle part été suivie par une reprise de l’épidémie que ce soit en Italie[25], en Irlande[26], en Grande-Bretagne[27], en Corée du Sud [28] ou en Israël [29], contrairement à ce que prévoyaient les simulations et les déclarations alarmantes des covido-terrorisants diffusées en France avant chaque rentrée scolaire.
La simulation alarmiste de l’institut Pasteur est totalement biaisée
La rentrée scolaire actuelle est à nouveau la cible de déclarations alarmistes par Gabriel Attal[30] porte-parole du gouvernement, le conseil scientifique [31], B. Lina[32], ou Vittoria Colizza[33], co auteure d’une simulation Pasteur[34] aussi fausse que les précédentes.
TENIR COMPTE DES CHIFFRES REELS ET NON D’ HYPOTHESES
Dans cette simulation mathématique, les auteurs ont pris comme hypothèse que les enfants de moins de 14 ans regrouperaient 30% des contaminés alors qu’en réalité ils ne représentaient que 5% des contaminés de la première vague[35] et ne dépassent pas 10 % des contaminés début septembre 2020 .
Cette même simulation est basée sur l’hypothèse que les enfants seraient à l’origine de la moitié des transmissions virales, ce qui est totalement contraire à toutes les analyses des faits avérés et constitue une colossale sur estimation.
Rappelons tout particulièrement l’étude épidémiologique menée par l’Institut Pasteur lui-même dans des écoles de Creil sur 510 enfants de six écoles primaires : les cas déclarés dans ces écoles avant les vacances n’ont pas donné lieu à des cas secondaires, que ce soit parmi les autres écoliers ou parmi les enseignants. Les modélisateurs de l’institut Pasteur lisent-ils les enquêtes épidémiologiques de leurs collèges ?
Quant au ratio de transmission R, la simulation le fixe à 7 ce qui également notablement plus élevé que ceux observés à l’étranger même pour le variant delta.
La surestimation systématique invraisemblable des trois facteurs clefs de la simulation montre qu’elle a été conçue par ses auteurs pour persuader nos dirigeants que les enfants représenteraient un facteur important de transmission et que leur vaccination pourrait diminuer ce risque.
Ce n’est pas une étude scientifique mais un pur article de propagande covid terrorisante, destinée à faire injecter des vaccins aux enfants qui ne peuvent en aucun cas en tirer un bénéfice personnel alors qu’ils peuvent souffrir de graves complications post vaccinales dont les myocardites.
Cette prépublication de l’institut Pasteur, à ce jour toujours non examinée par des pairs, a pourtant inspiré à nouveau les décisions du conseil scientifique et de nos gouvernants.
LE PASTEUR GATE
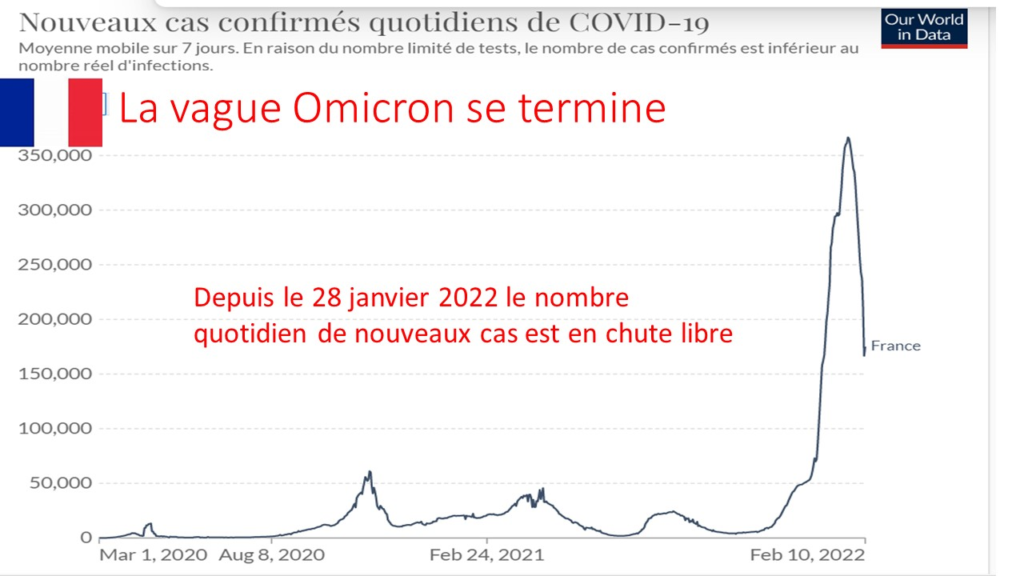
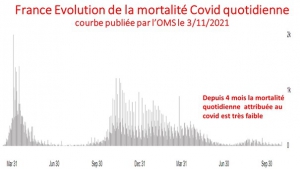
Pour juger de la valeur de cette profession de foi catastrophe qui constitue un véritable « Pasteur Gate », il suffit de comparer sa prédiction (un pic de 5 200 hospitalisations quotidiennes, bien au-delà de la première ou de la seconde vague) à la situation réelle actuelle d’une moyenne de 350 hospitalisations quotidiennes et en baisse constante depuis un mois. Quinze fois plus !
Cette publication et la médiatisation dont elle a immédiatement bénéficiée[36] constitue une illustration du phénomène des propagandistes professionnels déguisés en leur rôle de scientifiques pour servir la fonction de fabrication du consentement pour les politiques gouvernementales. De la même manière, tout au long de la pandémie, les médias grand public alarmistes ont généralement fait du plaidoyer politique plutôt que du journalisme.
La situation sanitaire actuelle ne justifie aucune des mesures qui briment les enfants et induisent de nombreux troubles physiques et psychologiques
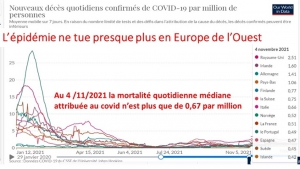
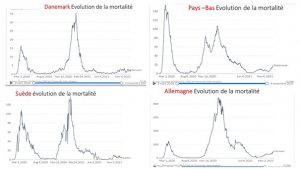
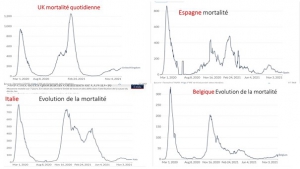
La situation sanitaire Covid globale est en effet en constante amélioration en France depuis août avec un nombre de nouveaux cas quotidiens actuels inférieure à 7000, soit 8 fois moins par million d’habitant qu’en Israël et quatre fois moins qu’en Grande-Bretagne champions historiques de la pseudo vaccination massive.
Et cette amélioration globale se marque aussi sur le nombre d’hospitalisations quotidiennes actuelles inférieure à 350, (soit 4 fois moins par million d’habitants qu’en Israël et deux fois moins qu’en Grande-Bretagne),
et sur le nombre quotidien d’admissions en soins intensifs (-50% en un mois) qui est très proche de celui d’Israël à la population 8 fois moins élevée.
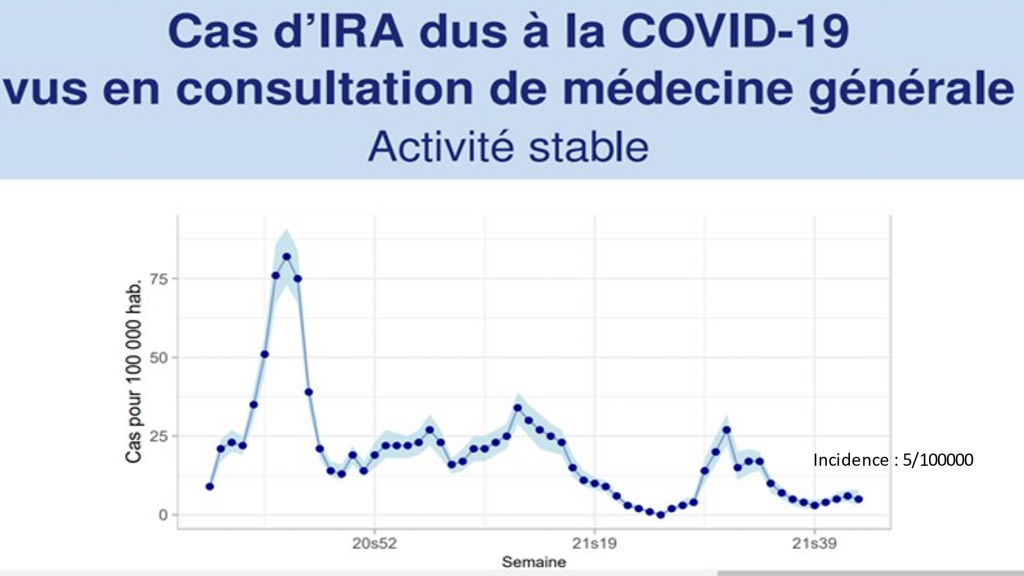
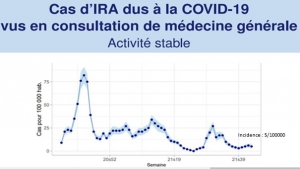
Cette amélioration globale se ressent tout particulièrement chez les enfants que le Covid a totalement abandonnés ainsi que le montre le dernier graphique du réseau sentinelle
« La semaine dernière (2021s36), le taux de positivité au SARS-CoV-2 des patients de 0-14 ans consultant pour une insuffisance respiratoire aigüe était de 0%
Les restrictions des activités scolaires et le port obligatoire du masque par les enfants et les menaces d’obligation vaccinale des enfants en France constituent donc bien des brimades dogmatiques contraires à l’état actuel de la science basé sur les faits avérés. Les dégâts qui en résultent sont malheureusement bien réels et considérables.
Les mesures sanitaires ont infligé des dommages considérables aux enfants
Difficultés d’apprentissage du langage dues au masque, décrochage scolaire massif en particulier des enfants défavorisés, démotivation des élèves et des enseignants, problèmes psychiques parfois très graves, confirmés dans de nombreux services d’urgences pédopsychiatriques (dont des suicides d’enfants très jeunes inconnus jusqu’ici),
« l’école à distance a provoqué beaucoup de dégâts en termes de santé mentale » dit le pédiatre François Angoulvant. Il ne fait d’ailleurs que répéter ce que toutes les sociétés de pédiatrie affirment depuis le premier confinement.
Didier Jourdan, titulaire de la chaire UNESCO et Directeur du centre collaborateur OMS Education et Santé constate[37] : « la fermeture des écoles dans le cadre du confinement a eu un impact sur la santé mentale et physique des enfants, principalement pour les plus vulnérables d’entre eux car fermer les écoles c’est limiter l’accès à des repas équilibrés, à des services sociaux et sanitaires etc. Le confinement influence également l’éducation en termes de pertes d’apprentissage pour les enfants et d’accroissement des inégalités… »
La poursuite d’études après le secondaire aux États-Unis a baissé de 6,8 % du fait de la crise sanitaire, mais avec des écarts majeurs en fonction du niveau socioéconomique. La baisse est de 11,4 % pour les plus vulnérables contre 2,9 % pour les plus favorisés. En tout état de cause, la fermeture des écoles aura un impact durable sur les enfants.
L’agence statistique norvégienne a été la première au monde à souligner les dommages permanents causés par les fermetures d’écoles[38] [39] : « chaque semaine de fermeture des classe freine les chances de vie et réduit de façon permanente le potentiel futur de revenus ».
La Royal Society a estimé que : « les enfants britanniques pourraient perdre 40000 £ de leurs gains potentiels à vie à moins que les gouvernements britanniques ne puissent réparer les lacunes d’apprentissage causées par la fermeture des écoles »[40].
Après avoir nuit aux enfants par des mesures scientifiquement et médicalement injustifiées, les lobbyistes des marchands de pseudo vaccins veulent les exposer aux complications de leurs injections expérimentales qui ne peuvent leur apporter aucun bénéfice individuel (ni collectif), avec pour seul argument des simulations mathématiques truquées.
Battons-nous pour les protéger de cette ignominie.
[1] RETOUR SUR LA MANIPULATION VIA DES SIMULATIONS AU COURS DE LA « PLANDEMIE » COVID – Docteur Nicole Delépine (nicoledelepine.fr)
[2] Peter Brodin Why is COVID-19 so mild in children? Editorial Acta Paediatrica 24 March 2020.
[3] LiangSua the different clinical characteristics of corona virus disease cases between children and their families in China – the character of children with COVID-19 Emerging Microbes & Infections 2020, VOL. 9
[4] Wu Z, McGoogan JM. Characteristics of and important lessons from the coronavirus disease 2019 (COVID-19) outbreak in China: summary of a report of 72 314 cases from the Chinese Center for Disease Control and Prevention. JAMA 2020; published online Feb 24. DOI:10.1001/jama.2020.2648
[5] Liu Y, Yan L-M, Wan L, et al. Viral dynamics in mild and severe cases of COVID-19. Lancet Infect Dis. 2020. https://doi.org/10.1016/ S1473 -3099(20)30232 -2
[6] Weiyong Liu .et al: Detection of Covid-19 in Children in Early January 2020 in Wuhan, China N Engl J Med. 2020 2 Avril; 382 (14): 1370-1371
[7] Ya-Nan Han et al A Comparative-Descriptive Analysis of Clinical Characteristics in 2019-Coronavirus-infected Children and Adults Pediatrics April 2020
[8] Wen Yan Jiao et al Behavioral and Emotional Disorders in Children during the COVID-19 Epidemic THE JOURNAL OF PEDIATRICS 2020 www.jpeds.com
[9] Posfay-Barbe KM, Wagner N, Gauthey M, et al. COVID-19 in Children and the Dynamics of Infection in Families. Pediatrics. 2020;146(2): https://pediatrics.aappublications.org/content/146/2/e20201576
[10] Haiyan Qiu Clinical and epidemiological features of 36 children with coronavirus disease 2019 (COVID-19) in Zhejiang, China: an observational cohort study Lancet Infect Dis. 2020 25 mars; S1473-3099 (20) 30198-
[11] Benjamin Lee et William V. Raszka Covid19 transmission children are not to blame Pediatrics aug 2020, 146 e2020 004879; DOI: https://doi.org/10.1542/peds.2020-004879
[12] Kostas DANIS et al pour Santé Publique France Cluster of coronavirus disease 2019 (Covid-19) in the French Alps, 2020 Clinical Infectious Diseases Oxford University Press for the Infectious Diseases Society of America
[13] A Fontanet et al SARS-CoV-2 infection in primary schools in northern France: A retrospective cohort study in an area of high transmission medRxiv 2020
[14] Christèle Gras-Le Guen https://theconversation.com/rentree-scolaire-la-covid-19-nest-definitivement-pas-une-maladie-pediatrique-145287
[15] Heavey L, Casey G, Kelly C, et al. No evidence of secondary transmission of COVID-19 from children attending school in Ireland, 2020. Euro Surveill 2020 ;25 :2000903.
[16] ] Centre national de recherche et de surveillance de la vaccination. COVID-19 dans les écoles – L’expérience en NSW. Nouvelle-Galles du Sud, Australie : Centre national de recherche et de surveillance sur l’immunisation ; 2020
[17] Francesco Nunziata Aucune propagation du SRAS-CoV-2 des enfants symptomatiques infectés aux parents : une étude de cohorte prospective dans un milieu hospitalier contrôlé Pédiatre 3 août 2021; 9:720084.doi: 10.3389/fped.2021.720084. Collection électronique 2021.
[18] Ibid 13 https://www.medrxiv.org/content/10.1101/2020.06.25.20140178v2
[19] National Institute for Public Health and the Environment. Ministry of health, welfare, and sport. Netherlands. Children and COVID-19. Available: https://www.rivm.nl/en/novel-coronavirus-covid-19/ children-and-covid-19
[20] FR24 Seulement 0,01% des écoles touchées par des épidémies de coronavirus après la réouverture et aucun enfant n’a eu besoin de soins hospitaliers 24 aout 2020 https://www.fr24news.com/fr/a/2020/08/seulement-001-des-ecoles-touchees-par-des-epidemies-de-coronavirus-apres-la-reouverture-et-aucun-enfant-na-eu-besoin-de-soins-hospitaliers.
[21]. Tadatsugu Imamura Rôles des enfants et des adolescents dans la transmission du COVID-19 dans la communauté : une analyse rétrospective des données nationales au Japon Pédiatr., 10 août 2021 | https://doi.org/10.3389/fped.2021.705882
[22] https://www.theguardian.com/education/2020/aug/23/covid-outbreaks-in-english-schools-uncommon-says-phe
[23]Fenton L, Gribben C, Caldwell D, Colville S, Bishop J, Reid M, White J, Campbell M, Hutchinson S, Robertson C, Colhoun HM, Wood R, McKeigue PM, McAllister DA. Risk of hospital admission with covid-19 among teachers compared with healthcare workers and other adults of working age in Scotland, March 2020 to July 2021: population based case-control study. BMJ. 2021 Sep 1;374:n2060. doi: 10.1136/bmj.n2060. PMID: 34470747; PMCID: PMC8408959.
[24] ONU info https://news.un.org/fr/story/2021/01/1087212
[25] Lucie Barcellini La réouverture des écoles affecte-t-elle la séroprévalence du SRAS-CoV-2 chez les enfants d’âge scolaire à Milan ? PLoS Un 2 sept. 2021 ; 16 (9) : e0257046.
doi: 10.1371/journal.pone.0257046. Collection électronique 2021.
[26] Dong Y, Mo X, Hu Y, Qi X, Jiang F, Jiang Z, et al. Épidémiologie du COVID-19 chez les enfants en Chine. Pédiatrie. (2020) 145 : e20200702. doi: 10.1542/peds.2020-0702
[27] Un rapport du gouvernement britannique a révélé que lorsque les écoles ont rouvert en Angleterre et au Pays de Galles pendant l’été, les taux d’infection parmi les élèves n’ont pas augmenté par rapport au taux de la population existante.
[28] Une étude menée en Corée du Sud a montré aussi qu’il n’y avait pas eu d’augmentation des cas de Covid-19 dans les deux mois ayant suivi la reprise des cours en mai 2020
[29] Shirley Shapiro Ben David COVID-19 chez les enfants et effet de la réouverture des écoles sur la transmission potentielle aux membres du ménage Acta Pédiatre Septembre 2021;110(9):2567-2573. doi: 10.1111/apa.15962. Publication en ligne du 22 juin 2021.
[30] https://www.france24.com/fr/france/20210902-covid-19-faut-il-s-attendre-%C3%A0-une-flamb%C3%A9e-des-cas-avec-la-rentr%C3%A9e-scolaire
[31] https://www.leparisien.fr/societe/covid-19-pourquoi-la-rentree-scolaire-fait-craindre-une-reprise-epidemique-01-09-2021-6T3MMDOOIZDJTDYJEOJBVGK35Q.php
[32] Le professeur Bruno Lina, virologue, membre du conseil scientifique, affirme jeudi 2 septembre sur franceinfo que la rentrée scolaire « amène un risque supplémentaire de reprise épidémique »
[33] « les mineurs pourraient représenter presque 50% des cas en septembre ».
[34]P Bosetti1, C Tran Kiem,, A Andronico, V Colizza, Y Yazdanpanah, A Fontanet D Benamouzig, S Cauchemez Epidemiology and control of SARS-CoV-2 epidemics in partially vaccinated populations: a modeling study applied to France 2021.
[35] D’après un rapport publié en août 2020 par l’Agence Européenne du contrôle et des maladies
[36]M Blachier La 4ème vague va arriver (C News) basée sur la simulation de Pasteur
[37] https://www.thinktankcraps.fr/la-fermeture-des-ecoles-a-un-impact-durable-sur-les-enfants/
[38] https://fr.businessam.be/norvege-le-confinement-netait-pas-necessaire-pour-gerer-le-covid-19/
[39] COVID-19-EPIDEMIEN : Kunnskap, situasjon, prognose, risiko og respons i Norge etter uke 18 Folkehelseinstituttet, 5. mai 2020
https://www.fhi.no/contentassets/c9e459cd7cc24991810a0d28d7803bd0/notat-om-risiko-og-respons-2020-05-05.pdf
[40] ht tps://www.fr24news.com/fr/a/2020/07/les-enfants-britanniques-pourraient-perdre-3-de-leurs-revenus-a-vie-en-raison-des-fermetures-decoles